【佳学基因检测】左心房心肌病的基因解码、基因检测及其个性化的治疗
左心房心肌病的基因诊断及个性化治疗
左心房心肌病 (LACM) 多年来一直是研究的焦点。有证据表明左心房心肌病是导致不明原因的心房颤动和栓塞性中风的原因。因此,正确诊断LACM具有临床意义。各种技术,包括心电图、超声心动图、心脏磁共振成像、计算机断层扫描、电解剖标测、基因测试和生物标志物,都可以识别和量化心房的结构、机械和电功能障碍。然而,问题是这些技术是否可以可靠地诊断 LACM。由于其异质性,临床诊断具有挑战性。迄今为止,对于疑似左心房心肌病的标准化诊断尚无建议。然而,标准化有助于更精确地对左心房心肌病进行分类并得出治疗方向以改善个体患者管理。此外,LACM 的统一诊断标准可能对未来的研究很重要。结合几个参数并将它们关联起来似乎有助于诊断 LACM。左心房心肌病的基因检测及个性化治疗概述了有关左心房心肌病诊断的当前证据,其中讨论了几个潜在参数,因此提出了诊断算法的建议。
关键词: 心房心肌病,诊断,心房颤动,不明原因栓塞性卒中,诊断算法
强调
- -左心房心肌病 (LACM) 是一种与左心房心肌组织病理学可检测到的结构和/或电学变化相关的常见疾病。
- -LACM 的临床意义源于其与未确定来源的心房颤动和栓塞性卒中的关联。因此,早期发现左心房心肌病可能对预防中风很重要。
- -已经研究了各种方法(包括心电图、超声心动图、心脏磁共振成像、计算机断层扫描、电解剖标测、基因检测和生物标志物)来确定左心房心肌病的诊断。然而,迄今为止,还没有普遍接受的建议。
- -左心房心肌病的基因检测及个性化治疗介绍了不同方法的当前证据,并提出了一种目前可用于诊断左心房心肌病的算法。
- -目前的工作有助于使未来的研究具有可比性并统一左心房心肌病的诊断标准。
介绍
心肌病可以在一定程度上影响心脏的所有部分,尽管有些类型主要涉及一个特定的腔室 。左心房心肌病 (LACM) 的概念并不是全新的,但最近变得更加重要和重要 。孤立性心房颤动 (AF) 患者和来源不明的栓塞性卒中 (ESUS) 患者特别受关注,因为左心房心肌病通常被怀疑为潜在疾病。先前的遗传研究确定了与 AF 以及左心房 (LA) 电和结构重塑相关的基因,例如 MYL4、Lamin-A、ETV1、Scn5a、Gja5、ErbB4、Tgfbr1/2、Igf1、TTN、众多胶原基因( 3 - 8)。然而,这可能仅适用于所有左心房心肌病患者中的一小部分。详细的家族史提供了重要和决定性的线索,在这些线索中患者基因检测可能是值得的。
左心房心肌病的定义
2016 年,发表了一份立场文件,以定义、表征和推导左心房心肌病的临床意义 。专家组将左心房心肌病定义为“影响心房并可能产生临床相关表现的结构、结构、收缩或电生理变化的任何复合体”(9)。该定义很宽泛,并非针对特定疾病,因为风险因素和合并症都可能牵涉并导致心房变化。因此,引入了分类来对左心房心肌病组织病理学进行分类。因此,LACM分为四类:主要是心肌细胞依赖性(I类)、主要成纤维细胞依赖性(II类)、混合心肌细胞-成纤维细胞依赖性(III类)和主要非胶原蛋白沉积物(IV类)。当然,经常存在混合表型,并且由于这是一个动态过程,随着时间的推移,类别变化是可能的。
然而,LACM 的异质性不仅导致分类困难,尤其是诊断困难。已经描述了几种诊断左心房心肌病的技术,例如心电图 (ECG)、超声心动图、心脏磁共振成像 (MRI)、计算机断层扫描 (CT)、电解剖标测、生物标志物和基因检测。另一个复杂的因素是在不同的研究中定义左心房心肌病的参数有很多。迄今为止,还没有针对左心房心肌病的随机对照试验。迄今为止,其他试图确定左心房心肌病诊断参数的研究也非常异质,因此难以比较。大多数研究以及共识文件都集中在房颤患者或中风患者身上。因此,应谨慎考虑派生参数,因为直接转移到左心房心肌病可能存在问题。然而,结合参数并将它们关联起来可能有助于最好地诊断 LACM。
因此,左心房心肌病的基因检测及个性化治疗的目的是概述当前左心房心肌病的诊断选择,突出不同方法的相互关系,并讨论临床价值。
临床影响
左心房心肌病和心房颤动
左心房心肌病与心房颤动密切相关,但房颤是否仅仅是LACM的标志物存在争议。另一方面,AF 会导致 AF,因此很可能会促进 LACM,因为 AF本身也会由于离子通道的变化和心房纤维化的发展而导致心房重构 。这种机制反过来再次导致 AF 稳定和从较低的 AF 负担进展到较高的 AF 负担。虽然非常短暂的 AF 发作不会改变纤维化程度,但持续时间较长的 AF 发作可能会导致 AF 诱发的左心房心肌病。此外,亚临床 AF 的存在,尤其是较高的负担,与血栓栓塞风险增加显着相关(13)。因此,假设存在亚临床 AF 可能是左心房心肌病的早期表现,其卒中风险增加,而不是血栓栓塞事件的根本原因 。
“孤立”房颤也被讨论为现有左心房心肌病的可能标志物。当没有潜在的解释和其他促进合并症时,诊断为“孤立”房颤 。血栓栓塞的风险较低,累积 15 年卒中风险为 1-2%,但随着心血管危险因素的数量增加,例如年龄、男性 。在“孤立性”AF 患者中,描述了心房心肌细胞的结构性心房重塑、传导障碍以及形态和炎症变化 。
左心房心肌病和不明来源的栓塞性中风
缺血性中风是心血管疾病发病率和死亡率的最常见原因之一。很大一部分缺血性卒中患者在未发现特定栓塞源的情况下被怀疑为栓塞性卒中 (ESUS) 。ESUS 的临床意义源于疾病的频率以及尽管抗血小板药物但新发中风的复发风险为每年 4-5% 的事实 。
这一概念的临床意义重大的治疗意义在于,由于栓子的发生,口服抗凝而非抗血小板治疗可能对这组患者有益。
相比之下,比较利伐沙班与乙酰水杨酸的 NAVIGATE-ESUS 试验和与达比加群的 RESPECT-ESUS 试验均未证明缺血性卒中或缺血性 MRI 病变在统计学上显着减少 。同样,最近在 2022 年欧洲卒中组织会议上发表但尚未发表的 ATTICUS 试验结果表明,阿哌沙班在 ESUS 和心脏血栓栓塞危险因素患者中并不优于乙酰水杨酸 。
然而,NAVIGATE-ESUS 试验的亚组分析表明,中度和重度 LA 扩张患者从利伐沙班治疗中获益显着 。结果表明,部分 ESUS 患者患有 LACM,这会增加心源性栓塞风险。
随机对照 ARCADIA 试验将评估阿哌沙班在预防 ESUS 和左心房心肌病患者中风复发方面是否优于阿司匹林 。根据研究人员的说法,LACM 定义为至少存在以下标准之一:V1 导联 P 波终末力 (PTFV1) > 5,000 μV*ms,血清 NT-proBNP > 250 pg/mL,LA 直径指数 ≥ 3 cm/m 2。ARCADIA 试验的结果将对左心房心肌病的二级预防和一级预防产生影响 。
不同研究中左心房心肌病的定义
左心房心肌病既是临床诊断又是组织学诊断 。一方面左心房心肌病和 AF 之间的关系,另一方面左心房心肌病和 ESUS 之间的关系表明,正确诊断左心房心肌病具有临床益处。如上所述,迄今为止,LACM 还没有统一的定义。几项研究对这种疾病进行了不同的描述,并使用了各种方法:
为了正确诊断 LACM,需要对心房心肌进行组织学检查。由于 LA 活检的侵入性,这在极少数患者中是一种选择(例如,在二尖瓣手术中)。因此,为了深入了解 LA 的组织学,左心房心肌病基因解码基因检测研究团队依赖于可以检测纤维化或疤痕的方法。为此,可以使用心脏 MRI、电生理学研究中的电解剖标测和 PET-CT。进一步的方法是处理左心房心肌病对机械或电气功能的影响。为了检测由左心房心肌病引起的机械功能障碍,除了 CT 和 MRI 外,还可以考虑超声心动图。此外,心电图参数适用于检测电功能障碍,这在左心房心肌病中可能是由 LA 的功能和形态变化引起的。图1)。实验室参数在何种程度上适合确定或提高诊断左心房心肌病的可能性仍不清楚。然而,一些实验室参数似乎适合确定病理生理学相关性(例如,具有免疫和炎症功能的 LACM)。

图1:LACM 图示为心房纤维化、机械功能障碍和电功能障碍的复合实体。对实体的评估是通过不同的方法实现的。CT,计算机断层扫描;心电图、心电图;f波,纤颤波;LA,左心房/左心房;LAA,左心耳;LACM,左心房心肌病;MRI、磁共振成像;PET-CT,心脏正电子发射断层扫描——计算机断层扫描。
综上所述,表格1总结了在不同研究中用作左心房心肌病标记的不同变量。
表1:评估左心房心肌病的不同方法和变量的概述,以及它们与临床结果和异常参数的关联
|
方法
|
范围
|
协会
|
参考
|
|
心电图
|
f波
|
超声心动图参数异常、左心耳 SEC 和血栓、AF 负担、年龄
|
|
|
PTFV1
|
缺血性卒中、房颤、BMI、年龄、超声心动图参数异常 |
|
|
|
P波区
|
缺血性中风
|
|
|
|
P波持续时间
|
缺血性中风、BMI、年龄、血压
|
|
|
|
高级房间传导阻滞
|
房颤,缺血性中风
|
|
|
|
放大的 P 波持续时间
|
超声心动图参数异常、左心耳血栓、主要不良心血管事件、房颤、消融后房颤复发、电解剖标测低电压区
|
|
|
|
人工智能概率
|
结构性心脏病、异常超声心动图参数、AF、死亡率
|
|
|
|
房性早搏复合体
|
超声心动图参数异常
|
|
|
|
经胸超声心动图
|
LA直径
|
房颤、缺血性卒中、主要不良心血管事件
|
|
|
洛杉矶体积指数
|
主要不良心血管事件、房颤、房颤负担
|
|
|
|
LA 排空分数
|
房颤,电解剖标测中的低电压区,消融后房颤复发
|
|
|
|
多普勒超声心动图
|
电子波速度
|
房颤负担
|
|
|
A波速度
|
自动对焦
|
|
|
|
PA-TDI 持续时间
|
房颤、房颤复发、血栓栓塞事件
|
|
|
|
3-D 和 4-D 超声心动图
|
洛杉矶体积指数
|
MRI异常延迟增强
|
|
|
LA 排空分数
|
MRI异常延迟增强
|
|
|
|
LA菌株
|
MRI异常延迟增强
|
|
|
|
斑点追踪超声心动图
|
LA菌株
|
房颤、房颤负担、血栓栓塞事件、电解剖标测中的低电压区、消融后房颤复发 |
|
|
LA机械分散
|
AF,电解剖标测中的低电压区域
|
|
|
|
经食道超声心动图
|
LA附肢血栓
|
MRI 异常延迟增强,LA 附肢血流动力学
|
|
|
证监会
|
MRI 异常延迟增强,LA 附肢血流动力学
|
|
|
|
心脏核磁共振
|
LA菌株
|
自动对焦
|
|
|
延迟增强MRI
|
LA 墙延迟增强
|
房颤、电解剖标测低电压区、超声心动图参数异常、CHA2DS2-VASc 评分、缺血性卒中、主要不良心血管事件、消融后房颤复发
|
|
|
4-D 流式 MRI
|
洛杉矶血流速度
|
AF 负担、CHA2DS2-VASc 评分、年龄、超声心动图参数异常
|
|
|
电脑断层扫描
|
洛杉矶体积指数
|
消融后 AF 复发,在斑点追踪超声心动图中可重现
|
|
|
LA菌株
|
可在斑点追踪超声心动图中重现
|
|
|
|
图像衰减率
|
电解剖标测中的低压区
|
|
|
|
PET-CT
|
18F-氟脱氧葡萄糖活性
|
缺血性卒中、AF、AF 负担
|
|
|
电解剖标测
|
低压区
|
AF、CHA2DS2-VASc 评分、缺血性卒中、MRI 中无症状脑缺血、消融后 AF 复发、CRP、超声心动图参数异常
|
|
|
生物标志物
|
炎症标志物
|
房颤、房颤负荷、消融后房颤复发、电解剖标测低电压区、超声心动图参数异常
|
|
|
纤维化标志物
|
房颤、消融后房颤复发、超声心动图参数异常、缺血性卒中 |
|
|
|
N端前B型利钠肽
|
房颤,超声心动图参数异常, |
|
|
|
N端前A型利钠肽
|
电解剖标测中的低压区
|
|
|
|
醛固酮
|
自动对焦
|
|
|
|
免疫血栓标志物
|
AF,主要不良心血管事件 |
|
房颤,心房颤动;BMI,体重指数;CRP,C反应蛋白;CT,计算机断层扫描;f波,纤颤波;LA,左心房/左心房;MRI、磁共振成像;PET-CT,心脏正电子发射断层扫描——计算机断层扫描;PTFV1,V1导联P波终末力;SEC,自发回波对比。
心电图
介绍
异常心电图可能会导致传导障碍和电重构。分析心电图参数的研究非常不同地定义了 LACM。详细阐述了与临床结果(例如,AF、缺血性卒中、主要不良心血管事件)和评估左心房心肌病的进一步成像技术(例如,异常超声心动图参数、电解剖标测中的低电压区域)的关联。表格1)。
颤动波(F 波)
纤颤波(f 波)的分析可能适用于检测心房的电生理和结构变化。“粗” AF 定义为 V1 导联 f 波幅度≥ 1 mm,与 LA 附件射血分数降低和最大排空速度降低有关 。此外,在存在“粗”房颤的情况下,观察到左心耳自发回声对比和血栓的发生率更高(22)。此外,阵发性、持续性和永久性 AF 患者的 f 波频率分别为 5.7 ± 0.7、6.1 ± 0.8 和 6.2 ± 0.6 Hz ( 23)。此外,老年患者的频率低于年轻患者。此外,f 波的幅度与超声心动图测量的 LA 体积密切相关 (图 2C)。

图 2:指示左心房心肌病的心电图变化示例。(A) V1 导联明显的 P 波终端力 ≤ –4,000 μV × ms(将 P 波第二项的幅度乘以该项的宽度)。(B) P 波持续时间延长 (≥120 ms) 和双峰形态。(C)幅度 > 0.1 mV 的“粗”心房颤动。(D)高级心房阻滞示例,定义为 P 波持续时间 ≥ 120 ms,同时在劣质导联中出现双相形态。
P 波指数
P 波首先代表右心房,然后是 LA 的心房去极化,因此对心房电重构特别感兴趣 。通过 Bachmann 束的心房间兴奋传导障碍也可以在 ECG 上检测到。P 波参数包括 P 波持续时间、P 波离散度、P 波轴、P 波电压、P 波面积、心房传导阻滞和 PTFV1 。首先,几个异常的 P 波参数与 AF 的发生有关。其次,它们可预测独立于 AF 的缺血性卒中,这表明它们可能反映心房重构,而与心律失常发生无关 ( 24)。此外,病理 P 波参数可能指示结构变化,例如心房扩大 。
导联 V1 中的 P 波终端力
心房重构的一个重要心电图标志物是 PTFV1。V1 导联中的 P 波通常是双相的,其中 P 波的第二个负项代表 LA 中的激发传播。PTFV1 是通过将 P 波第二项的幅度乘以该项的宽度来确定的。PTFV1 ≤ -4,000 μV × ms 被认为是病态的 。过去,多项研究表明 PTFV1 异常与晚期 AF 的发生之间存在关联 ( 25 – 28 )。此外,PTFV1 异常也与隐源性或心源性卒中相关,与 AF 的存在无关 ( 29 – 32 )。卡梅尔等人。( 33) 显示异常 PTFV1 与中风的发生比与 AF 的发生更密切相关。相比之下,P 波面积和持续时间与卒中发生无关 。然而,一项荟萃分析表明,异常 PTFV1、P 波持续时间、最大 P 波面积和缺血性卒中风险之间存在关联 。
相比之下,山本等人。 无法证明心源性卒中、腔隙性卒中和对照受试者的 PTFV1 异常患病率存在差异。
异常 PTFV1 也与功能重塑有关。首先,它与经食道超声心动图显示的低左心耳射血速度有关 。其次,通过斑点追踪超声心动图测量的作为功能性心房重构标志物的 LA 应变在 PTFV1 异常存在时显着降低 。PTFV1 与 LA 传导应变呈负相关。令人惊讶的是,在 PTFV1 异常的患者中,通过在心房活检中使用 Masson 三色染色量化的心房纤维化显着降低。结果表明,PTFV1 可能只是电性心房重构而非结构性心房重构的标志物 (图 2A)。
P 波持续时间和高级房间传导阻滞
然而,心源性和腔隙性卒中患者的最大 P 波持续时间显着延长。与对照组相比,缺血性卒中组的 P 波持续时间 ≥ 120 ms 和晚期心房传导阻滞(定义为 P 波持续时间 ≥ 120 ms 且下壁导联同时出现双相形态 [ 35 ])更为常见。同时,存在 P 波持续时间 ≥ 120 ms 和晚期心房传导阻滞与随后发生卒中的可能性较高相关,尤其是心源性卒中。晚期心房传导阻滞本身的发生也与 AF 的发生率和血栓栓塞事件的发生率有关 ( 25 , 38)。较高的体重指数 (BMI) 和年龄较大与 P 波持续时间延长和 PTFV1 异常相关,而较高的血压与 P 波持续时间延长和 P 波轴右偏相关 (图 2B、D)。
新型心电图参数
最近,Müller-Edenborn 等人。 进行了一项研究,包括患有 LA 附肢血栓的患者,以使用放大 P 波 (APW) 分析对血栓栓塞风险和心血管结果进行分层,以研究基于 ECG 的左心房心肌病诊断和分期。因此,LACM 阶段由 APW 持续时间定义,在数字心电图记录中测量 12 条导联中任何一条导联中从最早开始到最近激活的时间,使用标准放大到 40-80 毫米/毫伏和 100-200 毫米/秒的扫描速度,以及P波形态(40)。不,中度和广泛左心房心肌病在 2.8%、21.1% 和 76.1% 的左心耳血栓患者中普遍存在。左心耳血栓的优势比为 24.6 ( p< 0.001) 每个左心房心肌病阶段。此外,以左心耳流速为代表的心房收缩功能随着左心房心肌病分期的升高而下降,而主要不良心血管事件的发生率则增加 。异常的 APW 持续时间也与 AF 的较晚发作有关。射血分数保留的晚期心力衰竭 (HFpEF) 患者的 APW 持续时间 > 150 ms 会使新发 AF 的风险增加 10 倍 。APW 持续时间与 LA 指数体积无关,但与肺静脉隔离 (PVI) 后的无复发生存率相关。一致地,已证明 LA 低电压底物的电生理学证据与 APW 之间存在关联 ( 41 – 43 )。
无创体表心电图成像中总心房传导时间的持续时间与心内膜接触标测中的心房激活时间和 LA 低压底物的范围相关 。148 ms 的总心房传导时间值确定了 LACM,其敏感性为 91.3%,特异性为 93.7%,在总心房传导时间 > 148 ms 的患者中,PVI 后心律失常复发的可能性更高(44)。
最近,进行了一项“新型人工智能心电图分析”,以检测 613 名 HFpEF 患者可能存在的 LA 肌病 。该方法基于计算机辅助算法,该算法分析来自原始 12 导联心电图信号的数据,并包括关于 AF 概率的陈述 ( 45)。AF 人工智能概率较高的患者结构性心脏病更严重,左心室肥厚增加,LA 体积更大,超声心动图显示 LA 储层和增压应变减少。人工智能概率每增加 10%,在窦性心律且没有既往 AF 的患者中,新发 AF 的风险就会增加 31%。在总人口中,人工智能概率每增加 10%,死亡风险就会增加 12% 。
动态心电图也可能提供左心房心肌病的证据,因为缺血性卒中或短暂性脑缺血发作患者的过度心房早搏与 LA 重塑相关 。
超声心动图
经胸超声心动图
介绍
一方面,LA 扩大与心血管不良后果的发生呈正相关是众所周知的 。另一方面,扩大的 LA 也与 AF 的发生有关 。超声心动图是筛查和随访 LA 形态和功能异常患者的首选成像技术,因为它使用广泛、无创且成本效益高 。因此,超声心动图可能有助于检测 LACM。在调查超声心动图效用的研究中,LACM 的定义是证明 LA 大小异常与主要临床结果(如 AF、AF 负担、消融后 AF 复发和缺血性卒中)之间存在关联。表格1)。
左心房大小
用于估计 LA 大小的一个广泛使用的参数是 LA 直径 (图 3A)。在 AFFIRM 研究中,增加的 LA 直径与复发性 AF 相关,但与卒中风险无关 。然而,一项荟萃分析揭示了较大的 LA 直径与中风和血栓栓塞事件的发生率之间存在关联 。此外,大 LA 直径和 LA 体积指数都被证明是主要不良心血管和血栓栓塞事件的预测参数,特别是在没有 AF 的年轻患者中 。LA 容积指数更精确,因此更适合估计心房大小(图 3B)。增加的 LA 体积指数已被描述为心肌功能障碍的潜在早期标志物,并且经常出现在 AF 患者中,在更高的 AF 负担中频率增加 。此外,与似乎没有预测作用的最大 LA 体积相比,最小 LA 体积与新发 AF 和主要不良心血管事件的发生率密切相关 ( 53 – 56 )。

图 3:用于检测左心房心肌病的超声心动图测量示例。(A)测量左心房舒张期的直径。(B)左心房舒张期左心房容积的测量。(C)左心室舒张期的经口流入曲线:第一波代表 E 波(血液被动流入左心室),第二波代表 A 波(左心房主动收缩)。(D)左心室心肌运动的组织多普勒成像,结合(C)心房功能和左心室舒张末期压力的测量结果。(五)左心房的应变分析。(F)测量从 P 波开始(作为心房电活动开始)到 a' 波峰值(心房收缩的机械反应)的 PA-TDI 间隔。
除了代表结构重构的 LA 大小异常外,心房功能评估可能为左心房心肌病的存在提供进一步的重要指标。LA 扩大和 LA 排空分数降低都是 AF 患者的常见现象,LA 大小与排空分数呈负相关 。最近,Eichenlaub 等人。评估了 AF 患者的 LA 排空分数,用于诊断左心房心肌病和预测 PVI 后心律失常复发 。LACM 定义为心内膜接触标测在 0.5 mV 阈值时LA 低电压区域 ≥ 2 cm 2 。LACM 患者的 LA 排空分数低于没有左心房心肌病的患者(27 对 41%,p < 0.0001)(43)。此外,LA 排空分数 < 34% 是 LACM(曲线下面积为 0.846)和 PVI 后心律失常复发的重要预测因素(57)。
多普勒超声心动图
此外,可以通过脉冲波多普勒测量和组织多普勒成像来评估 LA 功能。LA 功能受损可能提示 LACM,在使用多普勒超声心动图的研究中,这与 AF 和 AF 负担等临床结果等同。表格1)。
过去,已经研究了许多与二尖瓣血流和舒张期心肌运动相关的超声心动图参数与 LA 功能和临床事件的关联 。然而,尚未确定适合诊断左心房心肌病的参数和相应的临界值。
虽然 LA 传导功能(以二尖瓣 E 波速度为代表)随着 AF 负荷的增加而增加,但 LA 收缩功能(以二尖瓣 A 波速度和二尖瓣环组织多普勒 a' 速度为代表)具有相反的效果。
。早期 [E] 和晚期 [A] 舒张期充盈波的比率增加与 AF 风险之间存在关联。此外,描述了峰值 A 波速度和 AF 风险之间的 U 形关系 。
二尖瓣环“e”波速度降低和 E/e 比增加表明左室舒张功能受损。有证据表明后一个参数也适用于评估 LA 功能和压力 (图 3C、D)。
通过组织多普勒成像持续时间评估的总心房传导时间
通过组织多普勒成像持续时间评估的总心房传导时间,代表超声心动图得出的总心房传导时间,是结构和电心房重塑的吉祥标志,在窦性心律期间测量为 P 波开始之间的时间间隔在表面心电图上的导联 II 和超声心动图上左室侧壁的组织多普勒成像 (TDI) 跟踪上的 A' 波峰值 (图 3F)。PA-TDI 持续时间延长与节律控制干预后新发 AF、术后 AF 和 AF 复发相关 。在 AF 患者中,血栓栓塞风险的评估通过增加 PA-TDI 持续时间值得到改善。迄今为止,尚未建立 PA-TDI 持续时间的标准参考值。然而,如果每个超声心动图实验室通过常规获取 PA-TDI 值来确定自己的正常值,则可能会改善对 AF 相关结果的风险评估 。
3 维和 4 维超声心动图
在过去几年中,3 维和 4 维超声心动图改善了 LA 体积测量的选择。使用 3 维和 4 维超声心动图的研究通过异常 LA 壁延迟增强来定义 LACM(表格1)。最近,在通过 4 维超声心动图调查 LA 纤维化的 LOOP 试验的子分析中,观察到最小 LA 体积、LA 排空分数和 LA 储层应变与通过心脏磁共振成像 (MRI) 测量的 LA 晚期钆增强相关。56 )。LA 排空分数对预测高 LA 晚期钆增强作用最强,因此预测 LA 纤维化 。
斑点追踪超声心动图
近年来,斑点追踪超声心动图已成为通过评估组织运动来检测早期心肌变形的流行方法 。LA 应变和应变率成像提供了对心房功能重塑的见解。图 3E)。评估斑点追踪超声心动图效用的研究主要通过临床定义(例如,AF、AF 负担、AF 复发、血栓栓塞事件)或通过与电解剖标测中的异常发现进行比较来定义 LACM。表格1)。
在严重二尖瓣关闭不全的患者中,通过全球峰值心房纵向应变评估的 LA 纵向变形损伤与 LA 纤维化和重塑程度之间存在很强的相关性 。在 AF 患者中描述了降低的全局纵向 LA 应变,并且是血栓栓塞的预测因子 ( 62 – 64 )。有证据表明,较高的 AF 负担 (≥10%) 与整体纵向 LA 应变的降低特别相关,这与通过映射测量的平均 LA 应变相关,并且可能在 AF 消融后得到改善 。在 Eichenlaub 等人的研究中。(57),预测左心房心肌病的 LA 纵向应变率 < 23.5%,定义为心内膜标测在 0.5 mV 阈值时 LA 低压面积 ≥ 2 cm 2,曲线下面积为 0.878,灵敏度为 92.3%,特异性为 82.4 %。在左心房心肌病患者中,储存期的 LA 应变率显着降低(15.2 对 29.4%,p < 0.0001),并且与左心房心肌病量呈线性相关(43)。
此外,将全球纵向 LA 应变和 LA 体积指数添加到 CHA2DS2-VASc 评分也提高了对住院和/或死亡率的预测 。
即使在窦性心律患者中,以心房纵向应变峰值和 LA 刚度指数为代表的 LA 舒张功能受限也与心内膜标测测量的低振幅电压区域密切相关 。
通过斑点追踪超声心动图,可以确定心房不同区域的功能重塑。例如,降低的 LA 侧壁纵向应变被发现是 AF 消融后心律失常复发的预测因素 。在淀粉样变性患者中,室间隔 LA 应变和应变率总体较低 。此外,与没有心力衰竭的患者相比,心力衰竭患者的侧向和间隔 LA 应变率降低 。
房颤患者的 LA 机械离散度(定义为由 RR 间期校正的正应变峰值时间的标准偏差 (SD) (SD-TPS, %)高于非房颤患者 。此外,SD-TPS 与新发 AF 的发生率相关(64)。还在接受 PVI 的阵发性 AF 患者中测量了 LA 机械离散度。SD-TPS 在低电压区患者中显着更高,通过映射测量,同时也是低电压区的独立预测因子 。
经食道超声心动图
经食道超声心动图的一个重要优势是更精确地评估左心耳。关于经食管异常与左心房心肌病相关性的证据有限,LACM 主要通过延迟增强 MRI 确定纤维化来确定。经晚期钆增强 MRI 诊断,与没有血栓的患者相比,有 LA 附肢血栓的患者有更多的 LA 纤维化 。有自发回声对比的患者的 LA 纤维化程度甚至高于没有的患者。此外,高心房纤维化患者更可能在左心耳同时出现血栓和自发回声对比(70)。众所周知,LA/LA 附件血流动力学减少和 LA 大小增加是血栓和自发回声对比发生的危险因素 (图 4)。

图 4:经食道检查提示左心房心肌病的结果。(A)左心耳口的血流减少。(B)左心耳自发回声对比的证据。(C)左心耳血栓的证据。
心脏磁共振成像
介绍
使用 MRI,可以检测 LA 体积和 LA 应变。通过 MRI 测量的 LA 应变降低存在于 AF 患者中 。已观察到斑点追踪超声心动图与 MRI 获得的 LA 体积和 LA 应变之间存在适度相关性 。由于 MRI 测量显示更高的值,因此应考虑测量的系统差异(73、74)。
延迟增强磁共振成像
近年来,延迟增强MRI成为检测心房纤维化的关键方法。旨在通过病理延迟增强 MRI 定义左心房心肌病的研究特别关注临床定义(例如 AF、缺血性卒中、主要不良心血管事件)以及进一步的影像学定义(例如异常超声心动图参数、电解剖标测中的低电压区域) (表格1)。
2009 年,Oakes 等人。建立了犹他阶段模型来量化 LA 纤维化 。根据该模型,将严重程度分为四个级别:犹他州 I,定义为 ≤ 5% LA 壁增强,犹他州 II,5–20%,犹他州 III,20–35%,犹他州 IV,>35% (图 5)。

图 5:左心房 MRI 检查示例:基于 3D 延迟增强磁共振成像扫描的左心房组织纤维化。正常左心房壁以蓝色显示,纤维化改变以红色和白色显示。纤维化量占左心房壁总体积的百分比。(A)犹他州第一阶段 (1%)。(B)犹他州第 3 阶段 (27%)。(C)犹他州第 4 阶段 (36%)。在 Misagh Piran 博士(Herz- und Diabeteszentrum Nordrhein-Westfalen,Ruhr-Universität Bochum)的友好支持下。
延迟增强 MRI 与来自 LA 结构重塑的手术活检组织学之间发现了高度相关性,包括间质和脂肪纤维化以及总纤维化和脂肪 。原生 T1 对应于 MRI 和组织学的纤维化程度 。此外,与没有 AF 的患者相比,AF 患者的 LA 壁增强似乎更大(77)。
延迟增强 MRI 发现的 LA 瘢痕区域与心内膜标测中的低电压区域有关 。
由于 LA 晚期钆增强与 LA 射血分数和超声心动图左室间隔 e' 和室间隔 E/e' 之间存在显着相关性,因此更高量的 LA 晚期钆增强与 LA 功能下降以及 LV 舒张功能下降有关(79)。斑点追踪超声心动图也证明了延迟增强和 LA 功能降低之间的相关性。延迟增强 MRI 测量的 LA 壁纤维化程度与斑点追踪超声心动图显示的 LA 应变和应变率之间存在反比效应,特别是 LA 中外侧应变和应变率(80)。有趣的是,与阵发性 AF 患者相比,持续性 AF 患者出现更多的纤维化和更少的中间隔和中外侧应变 。一般来说,新发房性心律失常的风险随着 LA 晚期钆增强量的增加而增加 。
既往卒中患者和卒中高危患者(表现为 CHA2DS2-VASc 评分高)在延迟增强 MRI 中 LA 纤维化的比例显着增加。LA 纤维化是脑血管事件的独立预测因子,显着提高了 CHA2DS2-VASc 评分的预测能力 。上升的犹他阶段和更强烈的 LA 晚期钆增强与主要心血管事件的风险增加有关,主要是由于中风或 TIA 的风险增加(82)。有趣的是,与 AF 患者相比,ESUS 患者的心房纤维化程度相似,这支持了纤维化是缺血性卒中和左心房心肌病的主要危险因素的假设(83)。
通过延迟增强 MRI 测量的结构性 LA 重塑程度似乎与 AF 类型(孤立性 AF 或非孤立性 AF)无关(84)。已证明 AF 消融后的结果显着取决于结构性 LA 重塑的程度,在犹他州分期增加时结果更差 。随着延迟增强水平的增加,消融后 AF 复发的发生频率更高(75)。因此,通过延迟增强 MRI 进行的消融前 LA 纤维化评估可以预测结果 。另一项研究 LA 纤维化对 AF 消融后结果的影响的研究表明,延迟增强 MRI 检测到的 LA 纤维化等级较高时,复发性心律失常的风险出现。77 )。较高的 LA 纤维化等级的存在也是成功消融的最佳预测指标,而增加的 LA 体积和持续性 AF 没有预测作用 。
DECAAF 研究评估了延迟增强 MRI 测量的 LA 纤维化对 AF 消融后结果的影响 。在接受 AF 消融的 329 名患者中,延迟增强 MRI 估计的 LA 纤维化程度与心律失常复发显着相关 。前瞻性、随机、多中心 DECAAF II 研究进一步深入了解通过延迟增强 MRI 对经历 AF 消融的持续性 AF 患者进行术前 LA 纤维化评估的价值 。在 2021 年 ESC 大会上公布但尚未发表的结果表明,纤维化引导消融在减少 AF 复发方面并不优于传统 PVI 。
4维流动磁共振成像
4 维流动 MRI 随时间产生 3 维体积集(4 维)。这可以对心血管血流进行精确的定量评估 。在分析 LA 血流速度的研究中,LACM 已等同于临床定义(例如,AF 负担)和进一步的影像学定义(例如,异常超声心动图参数)(表格1)。
AF 患者的血流速度存在对比数据。一方面,有证据表明,在 4 维血流 MRI 测量中,与年龄匹配的对照组相比,历史上的 AF 患者在窦性心律的正常范围内具有相似的血流量 。另一方面,与对照组相比,AF 患者的 LA 平均速度较低,LA 淤滞更常见 。
然而,与窦性心律的 AF 患者相比,持续性 AF 患者的 LA 血流量显着降低 。此外,在增加的 CHA2DS2-VASc 评分和降低的平均 LA 速度之间观察到负相关 。有趣的是,LA 血流指数、年龄和 LA 体积之间存在相关性,但与左心室射血分数无关 。
心脏计算机断层扫描
心脏计算机断层扫描
众所周知,心脏 CT 可用于精确测量心房体积 。已经观察到通过 CT 获得的 LA 体积指数与斑点追踪超声心动图之间的高度相关性 。此外,CT 测量的 LA 体积指数是消融后 AF 复发的预测指标 。
此外,最近已证明 CT 也可用于应变测量。由 CT 测量的 LA 应变与从散斑追踪超声心动图 ( 94 – 96 ) 得出的应变测量密切相关。
此外,CT可以检测到心房的结构变化。CT 收集的图像衰减率可预测电解剖标测中的 LA 低电压区域,这表明当存在 MRI 禁忌症时,CT 有助于评估纤维化 。
心脏正电子发射断层扫描 - 计算机断层扫描
近年来,正电子发射断层扫描 - CT (PET-CT) 中的心房 18F-氟脱氧葡萄糖活性与非 AF 个体的既往缺血性中风和左心房心肌病之间的关联得到证实 。LACM 定义为心房 18F-氟脱氧葡萄糖摄取增加本身或临床结果,如 AF、AF 负担和中风。表格1)。
心房活动增强与缺血性卒中和左心房心肌病相关(98)。此外,在 AF 患者中观察到 18F-氟脱氧葡萄糖的心房摄取较高,而持续性 AF 的心房摄取高于阵发性 AF 。持续性 AF 与右心房最大标准摄取值和 LA 体积特别相关。此外,与阵发性 AF 患者相比,持续性 AF 患者的最大标准摄取值与血池活动的右心房目标背景比似乎更大(99)。关于 18F-氟脱氧葡萄糖 PET-CT 在疑似左心房心肌病患者中的价值的数据非常罕见。18F-氟脱氧葡萄糖 PET-CT 可用于通过监测 AF 患者的疾病活动性来探索局部心房炎症和对随后中风的风险进行分层。然而,无法实现广泛用于检测 LACM。在接受 PET-CT 的肿瘤患者中,当怀疑有其他左心房心肌病时,可以补充使用该诊断工具。
电解剖标测和消融
介绍
电解剖标测是另一种有价值的方法,可为推测为左心房心肌病的患者提供更多见解。有大量研究旨在通过低电压区域的存在及其与临床定义(例如,AF、AF 复发、缺血性卒中)和进一步的影像学定义(例如,异常超声心动图参数)的关联来定义 LACM(表格1)。
左心房心肌病的电生理表现
阵发性孤立性 AF 患者表现出双心房异常,包括结构重塑、传导障碍和窦房结功能障碍 。这些患者的电生理检查结果包括心房容积增大、多个部位的有效不应期延长、沿线性导管的传导时间延长、双心房激活时间延长、传导速度降低、分次电图检查更频繁、校正窦房结恢复时间延长和降低电压(100)。
低压区
非局灶性 LA 心动过速患者在心内膜标测中出现高比例的低电压区域,为可能的左心房心肌病提供了证据 (图 6)。对纤维化左心房心肌病患者的分析显示,随着纤维化左心房心肌病的严重程度增加,严重的纤维化区域增加,最大 LA 电压降低(101)。
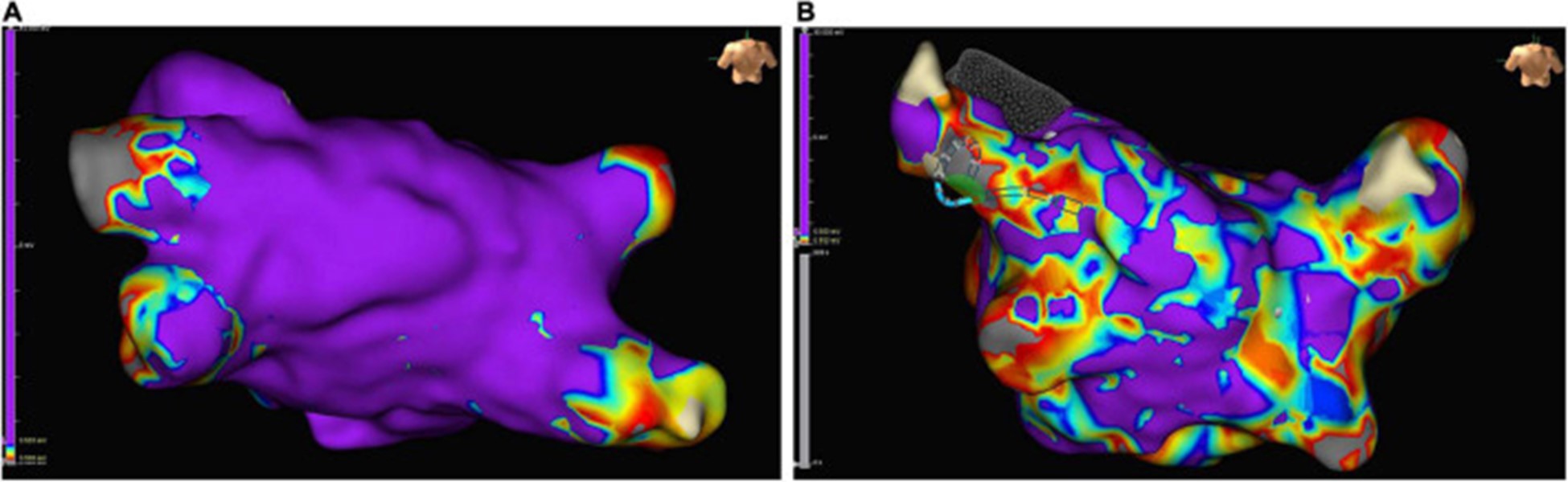
图 6:在接受肺静脉隔离的窦性心律患者的左心房心内膜标测中的低电压区域示例:正常传导的心房心肌呈紫色,低电压区域(定义为电感知幅度≤0.5 mV的区域)是颜色不同。(A)几乎没有低电压区域的左心房示例。(B)低电压区域 > 10% 的严重疾病左心房示例。
在较低的平均 LA 电压和较高的 CHA2DS2-VASc 评分之间发现了反比关系 。已经描述了电解剖 LA 重塑与 AF 患者中风风险之间的显着关联(102)。在既往卒中的 AF 患者中,即使在调整 CHA2DS2-VASc 评分后,通过脑 MRI 在 PVI 后检测到的低电压区域以及预先存在的无症状脑缺血明显更大(103)。虽然平均 LA 体积/体表面积,特别是前 LA 更大,但中风患者的 LA 心内膜电压更低 。
低压区域的定位
特别令人感兴趣的是低压区域的本地化。通过在 LA 瘢痕的下极和二尖瓣环之间形成传导通道,描述了前低电压区域和宏观再进入机制之间的关系 。虽然 LA 纤维化的分布通常是可变的,但通常在前部更明显 。已发现前部严重纤维化区域比后部严重纤维化区域更频繁且更大(104)。主要是前 LA 受到影响的知识允许采用个性化的消融方法来补充通常的策略 。
低压区域的量化和临床影响
LA 中高比例的低电压区域和纤维化区域预示着导管消融后 AF 的复发 ( 104 – 108 )。在多次消融的患者中,低电压区患者的 AF 复发率显着高于未消融的患者(36% vs. 6%,p < 0.001)(106)。纤维化区域的大小、LA 和右心房的纤维化以及降低的最大电压对消融结果有负面影响 。此外,LA 纤维化区域与更大的 LA 大小、降低的射血分数和更高的 C 反应蛋白水平显着相关 。
改良的 APPLE 评分(年龄 ≥ 65 岁、持续性房颤、估计肾小球滤过率受损 ≤ 60 mL/min/1.73 m 2、 LA 体积 ≥ 39 mL/m 2和 LA 射血分数 < 31% 为 1 分)可以估计导管消融的成功率 。
知道低电压区域的程度是消融成功的关键决定因素,个体化消融方法可能是有益的。除 PVI 外,在低电压区域内/边缘处消融具有显着激活特征的病灶可能比仅在持续性 AF 患者中采用 PVI 的传统策略更有效(110)。相比之下,单独 PVI 似乎足以治疗 LA 低电压 < 10% 的患者,因为单独接受 PVI 的低电压患者和需要 PVI + 选择性低电压的患者之间的成功率没有显着差异-电压消融(110)。
大多数评估电解剖标测对评估左心房心肌病的益处的研究包括接受导管消融的 AF 患者。有强有力的证据表明,AF 患者同时具有更多的低电压区域和严重的纤维化区域,反映了心房的电和结构重塑 ( 100 – 110 ) (图 6)。
生物标志物
介绍
已经提出了许多循环生物标志物来估计心房重构和左心房心肌病。研究通过临床定义(例如,AF、AF 负担、AF 复发、中风)以及进一步的影像学定义(例如,电解剖标测中的低电压区域、异常超声心动图参数)来分析定义左心房心肌病的生物标志物(表格1)。
炎症标志物
心房炎症被认为是心房纤维化和 AF 风险的关键因素 。代谢综合征是炎症过程的众所周知的危险因素。肥胖、高血压和糖尿病易患 AF 。心外膜脂肪组织分泌促炎和促纤维化细胞因子以及促纤维化 microRNA,这可能促进 AF 和炎症诱导的左心房心肌病的发展 。AF 患者的促炎性 IL-6 水平、MMP-9/TIMP-1 比值以及 NF-AT3 和 NF-AT4 mRNA 和蛋白表达显着增加,尤其是持续性 AF )。高敏感性 C 反应蛋白被描述为 AF 消融后心律失常复发的预测因子 。
在心内膜标测显示广泛低电压区域的患者中观察到单核细胞中 TGF-β1 水平升高(117)。此外,已经证明,较高的血清 TGF-β1 水平与 AF 消融后的 AF 和心律失常复发相关 。随着 AF 持续时间的增加,血清 TGF-β1 水平下降 。然而,血清 TGFß-1 水平对心律失常复发的预测价值似乎仅适用于非阵发性 AF 患者(120),并非所有研究都可以证明存在 AF 风险(121 ))。这同样适用于血清 TGF-β1 水平和超声心动图参数的一致性。一方面,有证据表明血清 TGF-β1 水平与 LA 直径之间存在反比关系 ,但另一方面也有一些发现无法证明相关性 。
纤维化标志物
此外,有人认为特定的纤维化标志物可能与心房重构有关。令人惊讶的是,III 型前胶原 N 末端肽、半乳凝素 3、成纤维细胞生长因子 23 和 I 型胶原 C 末端末端肽并不是 AF 消融后心律失常复发的预测因素 。III 型前胶原 N 末端肽在 AF 风险方面也仅显示出轻微的积极趋势 。然而,反映过度心肌 I 型胶原交联和沉积的循环生物标志物的组合显示出对消融后更高的 AF 患病率、发病率和复发率的预测作用(122)。此外,描述了 galectin-3 与评估 LA 的超声心动图参数之间存在负相关,包括 LA 体积和 LA 应变率 。ST-2 和凋亡微粒也与增加的 LA 体积指数有关 。此外,与没有 AF 的卒中患者相比,卒中合并 AF 患者的 galectin-3 和可溶性 ST-2 显着升高(125)。
心房肽
N-末端B型利钠肽前体是容量超负荷和心肌损伤引起的充血性心力衰竭的一个众所周知的指标。N 端 B 型利钠肽前体与 LA 重塑和功能障碍的超声心动图参数显示出强相关性,并且是 AF 的显着但较弱的预测因子 。此外,与AF负担有关。据报道,较高水平的 endothelin-1、N 末端前 B 型利钠肽、肌钙蛋白 I 与较低的 LA 储库和收缩应变之间存在反比关系,这表明 LA 肌病与持续充血有关 ( 126 , 127)。奥尔德格伦等人。评估了源自 ARISTOTLE 研究的 ABC 中风评分,包括年龄、生物标志物(N 端前 B 型利钠肽和高敏心肌肌钙蛋白)和临床病史(卒中前)(128、129)。在抗凝治疗的 AF 患者中,基于生物标志物的 ABC 卒中评分非常适用,通常比 CHA2DS2-VASc 和 ATRIA 卒中评分更适合 。
N-末端前A型利钠肽是心房响应增加的心房张力而释放的激素。最近,Seewöster 等人。介绍了新的基于生物标志物的 ANP 评分(年龄≥ 65 岁,N 端 pro-A 型利钠肽 > 17 ng/mL 和持续性 AF),该评分显着预测接受 AF 消融术的患者的低电压区域。130 )。
醛固酮和肾素
在持续性房颤患者中,成功消融房颤后,醛固酮水平和醛固酮/肾素指数显着下降。值得注意的是,醛固酮和肾素水平与 AF 持续时间、LA 直径、平均心率、收缩压、年龄、纽约心脏协会分级或左心室射血分数无关 。
免疫血栓标志物
免疫系统和凝血级联之间的密切相互作用可以用术语“免疫血栓形成”来概括。一方面,免疫系统启动凝血;另一方面,局部凝血具有促炎和促纤维化作用 。因此,免疫血栓形成可能是心房重构和 AF 的潜在机制 。在过去的几十年中,在 AF 患者中描述了几种凝血标志物,它们对血栓栓塞和出血风险都有影响。例如,血管性血友病因子、D-二聚体、生长分化因子 15、可溶性 p-选择素、凝血因子 Xa 和内皮一氧化氮合酶水平异常表明心内膜重塑 ( 135 –140 )。然而,最近的一项研究在调整心血管危险因素后未能证明免疫血栓标志物与发生 AF 之间的相关性 。这可能表明炎症和免疫血栓形成可能通过其他心血管危险因素与 AF 相关,而不是 AF本身。
结论
循环生物标志物可以提供心房炎症和纤维化途径的证据。然而,有时会出现相互矛盾的结果,并且炎症和纤维化相关的生物标志物并不特异。因此,目前尚不清楚评估左心房心肌病的临床价值,常规筛查似乎值得怀疑。然而,调查这些途径的未来研究具有潜力,并且可以确定专门干预炎症和纤维化调节回路的治疗方案。
综上所述,表 2总结了在不同研究中用作左心房心肌病标志物的实验室参数。
表 2:与 LACM、AF 和血栓栓塞事件相关的选定生物标志物概述。
|
实验室参数
|
上调或下调与 AF 发生率相关
|
协会
|
参考
|
|
醛固酮
|
↑
|
房颤,复律后房颤复发
|
|
|
醛固酮/肾素
|
↑
|
房颤,复律后房颤复发
|
|
|
凝血因子 Xa
|
↑
|
房颤,心房重构
|
|
|
CRP
|
↑
|
消融后房颤复发
|
|
|
D-二聚体
|
↑
|
房颤患者的血栓栓塞事件
|
|
|
内皮一氧化氮合酶
|
↓
|
自动对焦
|
|
|
内皮素-1
|
↑
|
超声心动图参数异常
|
|
|
半乳糖凝集素3
|
↑
|
房颤、中风、超声心动图参数异常
|
|
|
生长分化因子 15
|
↑
|
自动对焦
|
|
|
IL-6
|
↑
|
AF、AF 负担
|
|
|
MMP-9
|
↑
|
AF、AF 负担
|
|
|
MMP-9/TIMP-1
|
↑
|
AF、AF 负担
|
|
|
NF-AT3
|
↑
|
AF、AF 负担
|
|
|
NF-AT4
|
↑
|
AF、AF 负担
|
|
|
N端前A型利钠肽
|
↑
|
电解剖标测中的低压区
|
|
|
N端前B型利钠肽
|
↑
|
房颤、房颤负担、超声心动图参数异常
|
( 114 , 125 – 129 )
|
|
III型前胶原N末端肽
|
↑
|
自动对焦
|
|
|
可溶性p-选择素
|
↑
|
自动对焦
|
|
|
可溶性 ST-2
|
↑
|
房颤、中风、超声心动图参数异常
|
|
|
TGF-β1
|
↑
|
房颤、房颤负荷、消融后房颤复发、电解剖标测低电压区、超声心动图参数异常
|
( 114 , 117 – 121 )
|
|
肌钙蛋白 I
|
↑
|
超声心动图参数异常
|
|
|
冯维勒布兰德因子
|
↑
|
房颤,中风
|
|
房颤,心房颤动;LACM,心房心肌病;CRP,C反应蛋白;IL-6,白细胞介素 6;MMP-9,基质金属蛋白酶 9;NF-AT,活化 T 细胞的核因子;ST-2,抑制致瘤性 2;TGF-ß1,转化生长因子 β1;TIMP-1,金属蛋白酶 1 的组织抑制剂。
风险因素
已经描述了发展为 AF 以及可能的左心房心肌病的结构和电重构的几个风险因素。LACM 可能因淀粉样变性、遗传性肌营养不良、充血性心力衰竭、房颤、阻塞性睡眠呼吸暂停、药物、酒精、心肌炎、遗传复极障碍、衰老、高血压、肥胖、糖尿病、心脏瓣膜病 (图 7)。
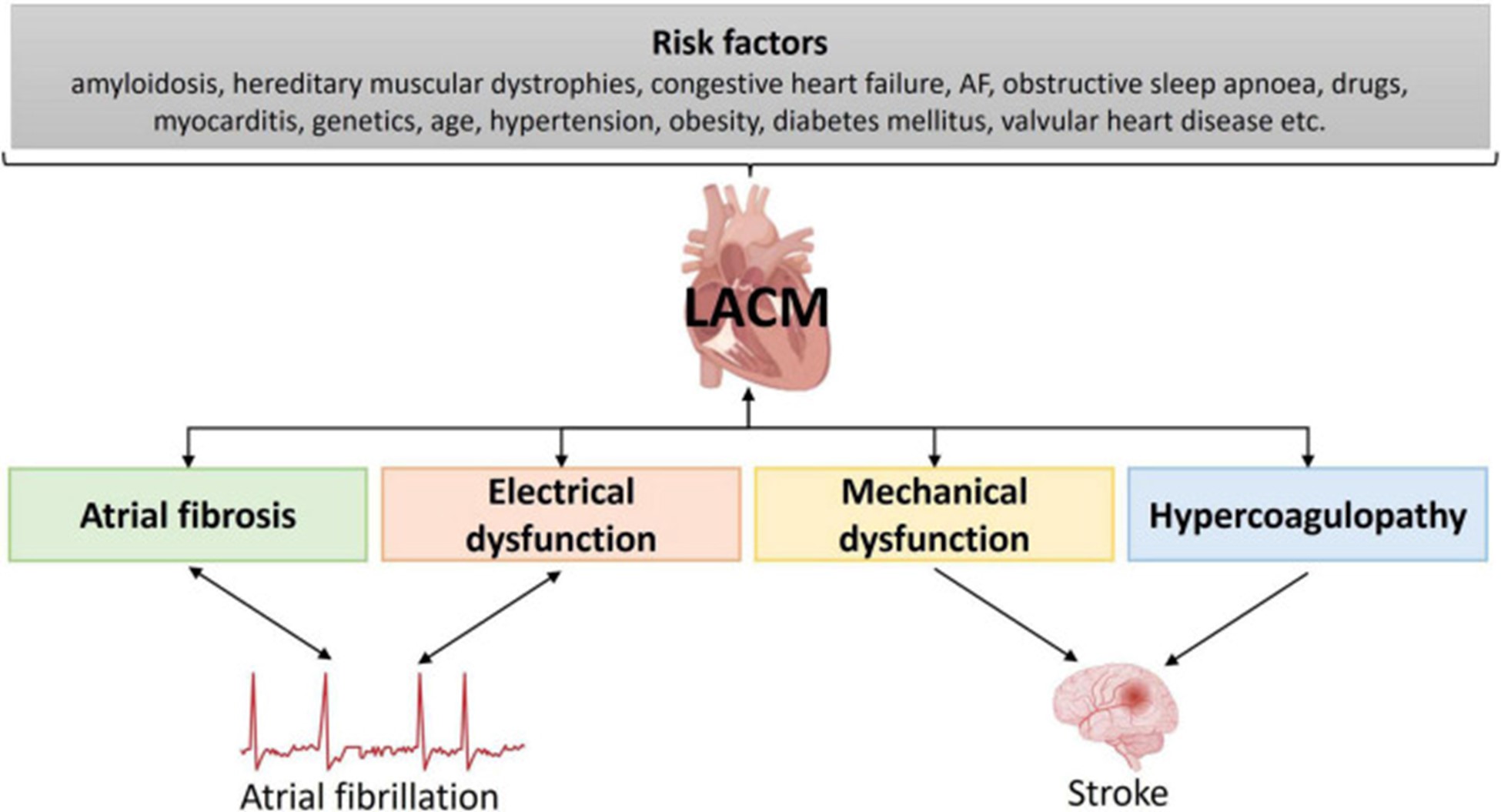
图 7:左心房心肌病潜在危险因素的说明。房颤,心房颤动;LACM,左心房心肌病。
新开发的 AF-SCORE(年龄 ≥ 60 岁+1 分,女性 [+1] 和 AF 持续性 [+2] 加分)能够很好地识别纤维化左心房心肌病并预测 PVI 后无心律失常(144 )。在任何年龄的阵发性 AF 患者和年轻的持续性 AF 患者中更常观察到低 AF-SCORE ≤ 2,无论性别如何,并且与更好的仅 PVI 结局相关 。
左心房心肌病概念和诊断的批判性思考
诊断
由于有几种诊断工具,对电、机械和结构性 LA 功能障碍的评估似乎是可行的。然而,单一的诊断程序可能不足以诊断 LACM。特别是,由于左心房心肌病的诊断具有挑战性,因此应寻求与左心房心肌病相关的参数组合。
临床终点
大多数数据来自包括 AF 和/或中风患者的研究。由于尚未完全了解如何诊断 LACM,因此很少有研究直接针对 LACM。因此,发现定义左心房心肌病的参数是模糊的,可能并不具体。关注 AF 患者可能很关键,因为它在 AF 发作之前忽略了亚临床 LACM。
研究的异质性
还应考虑到可能无法给出研究的可比性,因为左心房心肌病和其他参数(例如,低压区域)没有标准化定义。另一个重要的考虑因素是大多数研究将 LA 肌病与一般的心房心肌病等同起来。然而,也许右心房的心房心肌病不同于 LA 的心房心肌病。从洛杉矶到右心房的不合格转移是不合理的。需要进一步调查。许多关于左心房心肌病的研究仅分析了心房纤维化。然而,纤维化也可能由退化过程、年龄增长和其他合并症引起。LACM 很可能由一个复合实体组成。
治疗后果
区分左心房心肌病的严重程度对于识别高危患者很重要。可能的区分可以通过风险因素的存在或不存在来实现。毫无争议的是,存在伴有多种心血管危险因素的左心房心肌病对主要不良心脏事件构成高风险。然而,在没有风险因素的情况下,它变得更加复杂。这就提出了一个问题,即没有危险因素但有左心房心肌病证据的患者是否会从治疗中受益。进一步的突出问题涉及治疗和预防策略,其中可能包括更积极的节律控制、密切随访或口服抗凝剂的处方。相反,没有危险因素的患者也有较低的心血管风险。因此,
左心房心肌病和心房颤动
最极端的假设是导致中风的不是 AF 本身,而是与 AF 相关的左心房心肌病。中风预防可能成为治疗选择的关键。一方面,识别既往无房颤的高危患者很重要,另一方面,可以评估房颤患者是否需要口服抗凝剂。这些考虑也可能对 AF 消融后口服抗凝剂的使用产生影响。相反,口服抗凝剂的患者也有可能得不到充分管理(1)。
此外,AF 的存在或血栓栓塞事件的发生可能已经代表左心房心肌病的后期病程。通常假设左心房心肌病先于 AF 的发生。因此,LACM 的诊断标准随后来源于 AF 发生的预测因子。然而,预先存在的 AF 也可能触发心房重构。具有里程碑意义的概念“AF 导致 AF”可能不足以解决左心房心肌病的诊断,因为 AF 和心房纤维化之间可能存在双向关系(9)。不知道为什么会有如此大的个体差异。为什么一名患者的阵发性房颤持续数年,而另一名患者在数周内进展为持续性房颤?令人惊讶的是,即使心房纤维化程度极高的患者也可能表现为阵发性而非持续性 AF 。这种“先有鸡还是先有蛋”的情况,无论 AF 是左心房心肌病的症状还是左心房心肌病的触发因素,都无法最终解决。然而,重要的是要意识到片面的考虑和假设会导致左心房心肌病复杂临床模式的扭曲。
如何诊断左心房心肌病
这种难以捉摸的临床模式的另一个原因是当前的左心房心肌病分类,其基于心房组织病理学 。尽管该分类极大地帮助定义了左心房心肌病组织病理学,但它需要活检,这在临床环境中难以实施且不合理。希望随着临床诊断的改进,改进的分类可能成为可能(1)。迄今为止,尚无左心房心肌病临床诊断的推荐意见。此外,目前的分类还没有为治疗和预防策略提供任何指导(9)。同样,问题出现了是否可以通过临床诊断和临床分类来改善患者的管理。左心房心肌病的基因检测及个性化治疗试图朝着这个方向迈出第一步。
随机对照试验有助于改善存在左心房心肌病的诊断和治疗选择。这也可能为患者随访提供有用的建议。
诊断算法提案:如何诊断心房心肌病?
从本次审查中讨论的研究中,出现了一种难以诊断的疾病的复杂情况。用于诊断左心房心肌病的主要方法是心脏 MRI、电生理检查、超声心动图和心电图。相比之下,心脏 CT 和 PET-CT 的研究很少,而生物标志物的研究很多但不一致。
尽管仍然存在许多问题,但左心房心肌病基因解码基因检测研究团队想在此提出一个总结左心房心肌病的基因检测及个性化治疗的诊断算法(图 8)。该算法旨在说明诊断过程的复杂性,并可能有助于在未来定义左心房心肌病的统一标准。
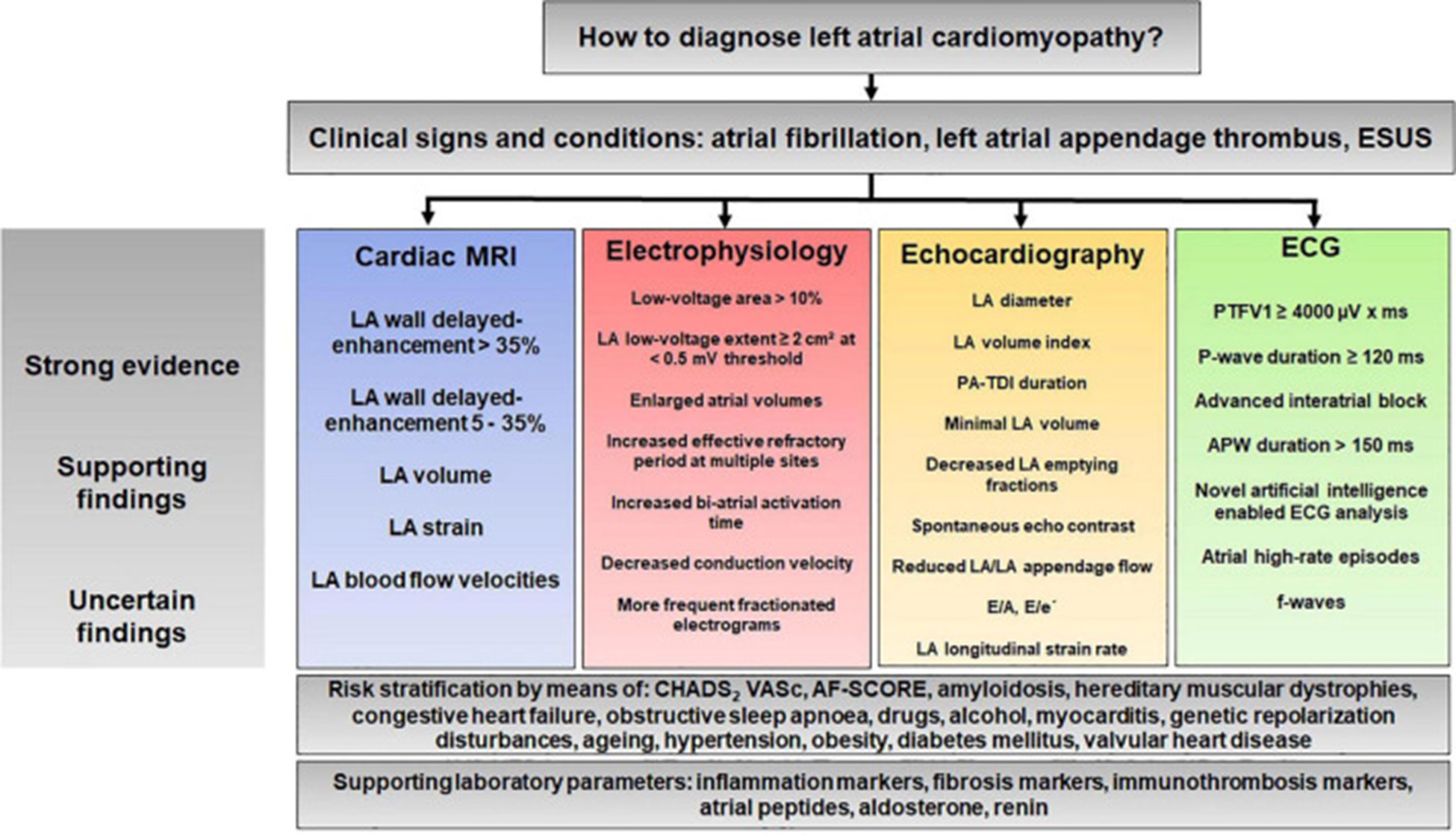
图 8:基于先前研究结果的心房心肌病诊断算法提案。APW,放大的 P 波;ESUS,未确定来源的栓塞中风;LA,左心房/左心房;PA-TDI,通过组织多普勒成像评估的总心房传导时间;PTFV1;V1导联P波终末力。
左心房心肌病的基因解码、基因检测个性人治疗的结论
专门针对左心房心肌病的研究极为有限,目前还缺乏随机对照试验。
左心房心肌病基因解码基因检测研究团队的综述试图通过应用和结合几个诊断标准来更准确地定义左心房心肌病的诊断。表格1和图 8)。这些标准反映了心房的电气、结构和机械重塑,并且可以在临床实践中获得。诊断方法和衍生参数的相互关系对于左心房心肌病的诊断是有趣和重要的,并为改进评估提供了机会。
迫切需要进一步调查以提高左心房心肌病患者的诊断能力和管理。
(责任编辑:admin)



