【佳学基因检测】基因检测在胸主动脉瘤诊断和风险分层中的作用
胸主动脉瘤诊断和治疗基因检测
诊断和管理胸主动脉瘤 (TAA/D) 的主要挑战是早期发现一种既致命又“难以捉摸”的疾病,因为它通常在破裂前无症状地生长,导致大多数人死亡的案例。主动脉夹层在发病率和治疗方案方面存在性别差异。已经努力确定可能有助于早期诊断和检测那些发生危及生命的并发症风险较高的患者的生物标志物。一旦证明了胸主动脉瘤/D 的遗传性,就发现一些遗传因素与疾病的综合征和非综合征形式有关,它们目前在患者诊断/预后和管理指导目的中发挥作用. 同样地,循环生物标志物可能是协助诊断的宝贵资源,一些研究试图确定可能有助于急诊科以外风险分层的特定分子。即使有希望,这些数据也缺乏特异性/敏感性,而且在大多数情况下,在进入“临床领域”之前还需要进行更多测试。这篇综述总结了实验室在胸主动脉瘤/D 诊断方面的最新进展,特别提到了分子遗传学检测的当前和未来作用。在进入“临床舞台”之前,他们需要更多的测试。这篇综述总结了实验室在胸主动脉瘤/D 诊断方面的最新进展,特别提到了分子遗传学检测的当前和未来作用。在进入“临床舞台”之前,他们需要更多的测试。这篇综述总结了实验室在胸主动脉瘤/D 诊断方面的最新进展,特别提到了分子遗传学检测的当前和未来作用。
关键词: 胸主动脉瘤,综合征性主动脉病,鉴别诊断,遗传学,生物标志物,基因诊断
1.主动脉瘤及基因检测知识介绍
尽管过去几十年在胸主动脉瘤 (TAA) 的病理生理学知识和诊断成像技术方面取得了长足的进步,加上诊断后更一致的监测计划,但它仍然是一种威胁生命且仍然“微妙”的疾病,真正的流行病学很难确定。除非发生急性主动脉事件,否则 95% 的 主动脉瘤 患者不会出现任何症状。因此,估计患病率保持在 6-10 例/100,000 名患者/年,与下降主动脉瘤相比,上升主动脉瘤更常见(60% 对 35%)。主动脉瘤最可怕的后果是主动脉夹层/破裂,这是影响主动脉的最常见的灾难性事件。在这方面,主动脉夹层的真实发病率也不容易评估,因为基于医院的报告显然没有考虑入院前的死亡,而众所周知,这些死亡涉及相当大比例的主动脉瘤个体。在最近的一项瑞典人群研究中观察到主动脉夹层的性别差异,估计男性的发病率在 15 年内下降。不同的是,在女性中,发病率没有显着变化。此外,接受胸腔内主动脉修复术 (TEVAR) 治疗的女性较少,与男性相比,她们的术后死亡率更高。
主动脉瘤传统上根据主动脉外临床表现的存在(综合征性胸主动脉瘤)或不存在(非综合征性胸主动脉瘤)进行划分。综合征型主动脉瘤患者的全身特征反映了结缔组织疾病的存在,例如马凡综合征 (MFS)、Loeys-Dietz 综合征 (LDS)、血管 Ehlers-Danlos 综合征 (vEDS) 和动脉迂曲综合征。二尖瓣主动脉瓣 (BAV) 是另一种常见的与主动脉瘤相关的疾病,目前被认为是其发展的独立危险因素,在某些情况下主动脉扩张,即使存在正常功能的 BAV 和/或不管体力活动,正如最近在儿科患者中评估的那样。非综合征性主动脉瘤占所有主动脉瘤病例的 95%,如果至少有一个一级家庭成员受到影响,则进一步分类为散发性或家族性。主动脉瘤的不同表现在扩张发育的分子病理生理学(受损的细胞外基质 (ECM))、胶原蛋白稳态、TGF-β 信号通路的改变、平滑肌和细胞骨架装置的破坏方面具有相似之处,即使外显率不同,遗传力显着。
根据 ESC(欧洲心脏病学会)指南,主动脉瘤的表现会对管理、干预措施和治疗策略产生影响,因为主动脉生长速度和进展在综合征和非综合征病例之间以及散发性和家族性病例之间存在差异。因此,早期识别无症状患者对于及时监测和管理策略至关重要,这些策略可能预防主动脉瘤和 TAD 的进展。这在缺乏明显临床表现(包括肌肉骨骼或眼部体征)可能延迟检测的非综合征病例中尤为重要。从实验室的角度来看,鉴于综合征/非综合征主动脉瘤最常以常染色体显性遗传模式遗传,分子遗传学分析代表了一种最有价值的工具,可以早期识别受影响的个体以及具有较高发展风险的个体在动脉瘤生长速度和夹层方面的不良后果。这与涉及升主动脉的主动脉瘤尤其相关,其病因主要与关键的遗传成分有关。此外,易于检测和特异性的循环生物标志物可能会进一步改善疾病的诊断和整体管理。这篇综述将讨论主动脉瘤的病理生理学驱动因素和相关的当前实验室测试的最新技术,以及遗传方法及其在支持检测和管理具有特征的疾病(慢、渐进和无痛的动脉瘤形成,通常是通过为其他目的进行的影像学研究“意外”诊断出来的),这使其多年来赢得了“沉默杀手”的邪恶名声。
2.主动脉瘤形成的驱动因素:基因发现的不断旅程
主动脉瘤特征、综合征表现和/或进展的复杂性和异质性是其发展背后的多种但独特的细胞和分子遗传机制的结果,这通常会导致相似的临床表现。正如家族聚集研究表明的那样,超过 20% 的患者至少有一个一级家庭成员患有动脉瘤,这基本上定义了受影响个体亲属的风险增加。关于该特征的遗传性的第一个线索来自病例对照研究,该研究比较了转诊胸主动脉手术患者的一级亲属中胸主动脉瘤、胸主动脉夹层和猝死的患病率,确定先证者一级亲属患这些疾病的风险高于对照组(先证者父亲、兄弟和姐妹的相对风险分别为 1.8、10.9 和 1.8)。对包含 598 名美国主动脉瘤评估患者的数据库的分析提供了更多关于促进主动脉瘤发展的遗传因素的证据,显示家族性病例的主动脉瘤生长速度较散发性病例更快,且发病年龄更小。此外,谱系也表现出不同的遗传模式(常染色体显性、X连锁、常染色体隐性)。最近的研究也进一步证实了遗传因素在引起主动脉瘤中的作用,分析了不同类型的动脉瘤。主要通过遗传和动物模型的研究,阐明了驱动主动脉瘤形成的破坏/改变的细胞过程的组合以及特定的相关基因(表1)。在这方面,必须注意,即使这两种情况传统上被认为是不同的实体(例如,ACTA2、SMAD3),哪些致病基因对综合征和非综合征主动脉瘤都产生重叠影响(表1)。
表格1:与胸主动脉瘤/D 相关的基因(综合征和非综合征)
|
生物过程/细胞室 |
基因 |
蛋白质 |
OMIM |
综合征胸主动脉瘤/D |
非综合征 FTAA/D |
相关综合症/疾病 |
|
细胞外基质/重塑 |
BGN |
大聚糖 |
300,989 |
+ |
- |
梅斯特-洛伊综合征。ARD、TAAD、肺动脉瘤、IA、动脉迂曲 。 |
|
COL3A1 |
III型胶原α1链 |
130,050 |
+ |
- |
EDS,血管 IV 型。TAAD、早期主动脉夹层、内脏动脉夹层、血管脆性 。 |
|
|
EFEMP2 |
含有纤维蛋白细胞外基质蛋白 2 的 EGF |
614,437 |
+ |
- |
皮肤松弛,AR Ib 型。升主动脉瘤、其他动脉瘤、动脉迂曲、狭窄 。 |
|
|
ELN |
弹性蛋白 |
123,700 |
+ |
- |
皮肤松弛。AD ARD、升主动脉瘤和夹层、主动脉瘤、BAV、IA 可能与 SVAS 相关。 |
|
|
FBN1 |
原纤维蛋白-1 |
154,700 |
+ |
+ |
马凡综合征。ARD、主动脉瘤、TAAD、AAA、其他动脉瘤、肺动脉扩张、动脉迂曲。 |
|
|
LOX |
蛋白质-赖氨酸6-氧化酶 |
617,168 |
- |
+ |
AAT10。AAA、肝动脉瘤、BAV、CAD、TAAD。 |
|
|
MFAP5 |
微纤维相关蛋白 5 |
616,166 |
- |
+ |
AAT9。ARD、主动脉瘤。 |
|
|
平滑肌细胞 |
ACTA2 |
平滑肌α-肌动蛋白 |
611,788 |
+ |
+ |
AAT6,多系统平滑肌功能障碍,MYMY5。早期主动脉夹层、CAD、中风(烟雾病)、PDA、肺动脉扩张、BAV、TAAD、主动脉瘤。 |
|
FLNA |
细丝蛋白A |
300,049 |
+ |
- |
脑室周围结节性异位和耳腭指综合征。主动脉扩张/动脉瘤、外周动脉扩张、PDA、IA、BAV、主动脉瘤。 |
|
|
MYH11 |
平滑肌肌球蛋白重链 |
132,900 |
- |
+ |
AAT4。PDA、CAD、外周血管闭塞性疾病、颈动脉 IA 、TAAD、早期主动脉夹层。 |
|
|
MYLK |
肌球蛋白轻链激酶 |
613,780 |
- |
+ |
AAT7。TAAD,早期主动脉夹层。 |
|
|
TGF-β信号 |
LTBP1 |
潜在的 TGF-β 结合蛋白 1 |
150,390 |
+ |
- |
主动脉扩张与相关的肌肉骨骼发现。牙齿畸形,身材矮小。TAAD、 |
|
LTBP3 |
潜在的 TGF-β 结合蛋白 3 |
602,090 |
||||
|
SMAD2 |
SMAD2 |
619,657 |
+ |
- |
带有动脉瘤/夹层的不明 CTD。ARD、升主动脉瘤、椎体/颈动脉瘤和夹层、AAA。 |
|
|
SMAD3 |
SMAD3 |
613,795 |
+ |
+ |
LDS III 型。ARD、TAAD 、早期主动脉夹层 、AAA、动脉迂曲、其他动脉瘤/夹层 、IA、BAV。 |
|
|
SMAD4 |
SMAD4 |
175,050 |
+ |
- |
JP/HHT 综合征。ARD,TAAD ,AVM,IA。 |
|
|
SMAD6 |
SMAD6 |
602,931 |
- |
+ |
AOVD2。BAV/主动脉瘤。 |
|
|
TGFB2 |
TGF-β2 |
614,816 |
+ |
+ |
LDS IV 型。ARD、主动脉瘤、TAAD、动脉曲折 、其他动脉瘤、BAV。 |
|
|
TGFB3 |
转化生长因子-β3 |
615,582 |
+ |
- |
LDS V 型。ARD、TAAD、AAA/夹层、其他动脉瘤、IA/夹层 。 |
|
|
TGFBR1 |
TGF-β受体 |
609,192 |
+ |
+ |
LDS 类型 I+AAT5。TAAD 、早期主动脉夹层、AAA、动脉迂曲、其他动脉瘤/夹层 、IA、PDA、BAV。 |
|
|
TGFBR2 |
TGF-β受体 |
610,168 |
+ |
+ |
LDS II 型+AAT3。TAAD 、早期主动脉夹层、AAA、动脉迂曲、其他动脉瘤/夹层 、IA、PDA、BAV。 |
|
|
其他 |
AXIN1/PDIA2 基因座 |
- |
- |
+ |
- |
BAV。BAV/主动脉瘤。 |
|
FBN2 |
原纤维蛋白-2 |
121,050 |
+ |
- |
契约性蛛形纲。罕见 ARD 和主动脉夹层 、BAV、PDA。 |
|
|
FOXE3 |
叉头箱 3 |
617,349 |
- |
+ |
AAT11。TAAD (主要是 A 型夹层)。 |
|
|
MAT2A |
蛋氨酸腺苷转移酶 II α |
呐 |
- |
+ |
FTAA 胸主动脉瘤 。BAV。 |
|
|
NOTCH1 |
缺口1 |
109,730 |
- |
+ |
AOVD1。BAV/TAAD 。 |
|
|
PRKG1 |
1型cGMP依赖性蛋白激酶 |
615,436 |
- |
+ |
AAT8。TAAD ,早期主动脉夹层,AAA,冠状动脉瘤/夹层,主动脉迂曲,小血管,CVD。 |
|
|
ROBO4 |
环岛导向接收器 4 |
607,528 |
- |
+ |
BAV。BAV/主动脉瘤。 |
|
|
SKI |
斯隆凯特琳原癌蛋白 |
182,212 |
+ |
- |
Shprintzen-Goldberg 综合征。ARD、动脉迂曲、肺动脉扩张、其他(脾)动脉瘤 。 |
|
|
SLC2A10 |
葡萄糖转运蛋白 10 |
208,050 |
+ |
- |
动脉迂曲综合征。ARD、升主动脉瘤 、其他动脉瘤、动脉迂曲 、细长的动脉、主动脉/肺动脉狭窄。 |
粗体:与解剖相关的基因。AAA:腹主动脉瘤;AAT/TAA:主动脉瘤,胸部;AD:常染色体显性遗传;AOVD:主动脉瓣疾病;ARD:主动脉根部扩张;AVM:动静脉畸形;BAV:二尖瓣主动脉瓣;CAD:冠状动脉疾病;CTD:结缔组织病;心血管疾病:脑血管疾病;EDS:埃勒斯-当洛斯综合征;FTAA:家族性胸主动脉瘤;FTAAD:家族性胸主动脉瘤和/或夹层;HHT:遗传性出血性毛细血管扩张症;IA:颅内动脉瘤;JP:幼年性息肉病;LDS:Loeys-Dietz 综合征;na:不适用;PDA:动脉导管未闭;SVAS:瓣上主动脉瓣狭窄;TGF:转化生长因子;TAAD:胸主动脉瘤和/或夹层。
2.1 细胞外基质成分
在导致和/或影响主动脉瘤发育的基因中,由于多年来通过动物研究收集的大量数据,总是首先提到那些编码 ECM 成分的基因,提供了它们对维持主动脉壁结构完整性的影响的证据. 这些成分密切相关,代表了细胞通路的关键因素、上游/下游和中间元素,这些因素已被证明以不同方式对动脉瘤发展/易感性产生影响,即主动脉壁弹性层的耗竭,升主动脉延长,胶原蛋白和弹性纤维的组装受损,TGF-β信号改变(图1)。
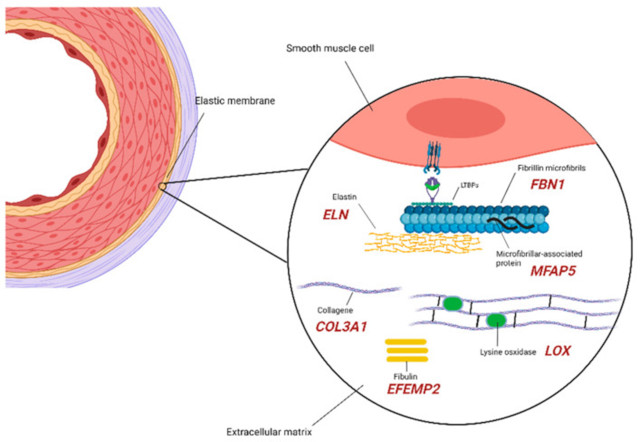
图1:ECM 主要组件的示意图。编码每个组件的基因以红色报告
FBN1基因 (15q21.1) 编码细胞外微原纤维 fibrillin-1的关键成分,在弹性蛋白(由ELN基因编码,7q11.23)组装和支持通过促进粘附到血管平滑肌细胞 (VSMCs)中起主要作用。与赖氨酰氧化酶(由LOX基因 5q23.1 编码)和纤连蛋白相互作用。有关于主动脉瘤引起变体的可靠数据可用,这些变体被发现是造成蛋白质合成/分泌受损或在微纤维结构中掺入突变原纤维蛋白的原因 。FBN1代表马凡综合征在综合征主动脉瘤中的致病基因(表格1),但在散发性、非综合征性主动脉瘤中也发现了涉及该基因的突变 ;此外,对综合征和非综合征胸主动脉瘤D 进行的大型全外显子组测序 (WES) 报告FBN1是该队列中突变最多的基因。
如前所述,原纤维蛋白 1 调节弹性蛋白的组装,弹性蛋白是一种在功能失调和/或耗尽时与主动脉瘤相关的蛋白质,即使需要额外的机制来启动扩张发展(改变整合素信号传导、粘着斑)。涉及ELN基因的突变是皮肤松弛的原因,这与 30-50% 的患者发现的主动脉扩张有关。关于主动脉瘤的非综合征表现,发现围绕弹性蛋白基因的三倍体在瓣上非综合征性主动脉瘤的家族中分离,其中皮肤松弛的诊断被排除在外。
弹性蛋白的稳定和组装还受LOX基因 (5q23.1) 编码的赖氨酰氧化酶蛋白的酶活性的调节,该酶催化溶素残基的氧化和弹性蛋白分子稳定性所需的那些交联反应. 发现涉及LOX基因的失活突变是 MFS、家族性主动脉瘤和夹层 (FTAAD) 和 BAV 患者发生主动脉瘤的原因,其机制仍有待完全阐明。
Fibulin-4 ( EFEMP2 11q13.1 ) 和 III 型胶原蛋白(由COL3A1基因 2q32.2 编码)代表LOX基因编码的酶的底物,当对涉及两个编码基因。基质糖蛋白 fibulin-4 可作为赖氨酰氧化酶活性的增强剂和未成熟弹性蛋白分子的募集者:突变时,主动脉壁上弹性纤维和胶原蛋白的破坏会驱动动脉瘤形成,如人类和小鼠所示模型。描述 fibulin-4 的类似机制来自COL3A1的突变,vEDS 的致病基因,主要功能是防止主动脉壁的灾难性破坏,这可能是由于胶原蛋白的沉积和成熟受损,主要是主动脉瘤的综合征形式。
已发现可驱动主动脉瘤形成的其他失调的 ECM 关键成分是微纤维相关糖蛋白 2(MFAP5基因,12p13.3)和双糖链蛋白聚糖(BGN,Xq28)。由于与 fibrillin-1 相互作用的丧失,第一个基因的功能丧失突变会损害 TGF-β 和 notch-1 信号传导。在一名患有轻度主动脉瘤的患者中发现了一种可能的致病变异,该患者仅限于升主动脉、BAV 和与结缔组织疾病一致的细微颅面特征。BGN 突变导致主动脉瘤的综合征形式。它的功能再次与 TGF-β 信号通路的改变有关,在其中它充当负调节剂,增加 TGF-β 的生物利用度。
2.2. SMC(平滑肌细胞)隔间
主动脉大部分由 SMC 群构成,其细胞成分的收缩特性的维持受到高度控制和调节。事实上,分子研究表明,这个严格监管的系统的不同水平的损伤使个体易患胸主动脉瘤。在参与这种细胞机制的蛋白质中,由ACTA2基因 (10q23.31)编码的 α-平滑肌主动脉在维持收缩性方面发挥着重要作用,其消耗反过来又与单体组装成聚合物的能力下降有关细丝,最终损害肌动蛋白-肌球蛋白收缩单位。数十年的研究证明,该基因的突变是家族性和非家族性非综合征性胸主动脉瘤D的重要原因,占胸主动脉瘤D 的 12-21%。
细丝蛋白A(FLNA基因,Xq28)是一种锚定细胞骨架蛋白,在其多种功能中,它充当肌动蛋白丝之间的接头。在对携带功能丧失性FLNA突变的脑室周围结节性异位的儿科和成人患者进行大型系统分析以及最近在一名有系统性红斑狼疮病史的主动脉瘤患者中发现,主动脉瘤频率为 18.4% 。
肌球蛋白重链 11(MYH11基因,16p13.11)与 α-肌动蛋白相互作用,控制其状态变化并使肌动蛋白丝结合。MYH11传统上也被归类为主动脉瘤的主要非综合征基因,并被证明与其他表现有关,如主动脉僵硬,这是该疾病的早期标志。然而,必须注意的是,MYH11缺陷占所有非综合征性胸主动脉瘤D 的 <1%,解剖前主动脉直径通常 >5 厘米。稳健的数据支持FLNA、MYH11和ACTA2中共享缺陷的想法机械,确定血管壁的机械强度破坏和收缩力维持失败是主动脉瘤进展的重要原因,特别是在非综合征病例中。
MYLK基因 ( 3q21.1 ) 编码肌球蛋白轻链激酶,调节肌动蛋白-肌球蛋白相互作用和磷酸化肌球蛋白轻链,其最具破坏性的突变再次主要在非综合征性胸主动脉瘤D (图 2)。
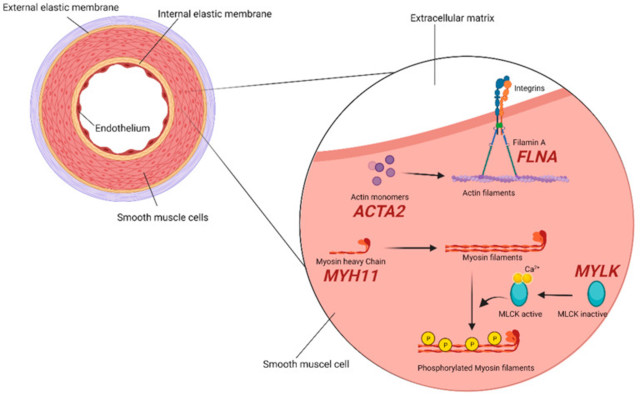
图 2:SMCs 隔间主要组件的示意图。编码每个组件的基因以红色报告
2.3. TGF-β 信号转导
据报道,在与马凡综合征和 LDS 相关的主动脉瘤患者中,编码 TGF-β 信号正向和负向调节因子的基因中存在突变库,这些大量的动物研究代表了第一个也是主要贡献之一以我们对动脉瘤发病和生长的理解。事实上,TGF-β信号传导在血管发育和维持、收缩蛋白表达的正向调节、细胞分化、增殖和稳态等一系列血管细胞过程中发挥着关键作用,这些机制已被证实在所有类型的 LDS 中失调。已经提出了不同的模型作为主动脉壁扩张的基础,其中一种模型表明 TGF-β 信号传导的减少会导致收缩蛋白的表达受损,类似于ACTA2和MYH11基因突变的影响。或者,引起 LDS 的突变增加了 VSMC 的信号传导能力,导致心脏神经嵴衍生的 VSMC 对 TGF-β 的反应性缺陷,其在近端胸主动脉中高度丰富,并且过度激活 TGF-β 信号传导。TGF-β 由许多类型的细胞(包括巨噬细胞)分泌,作为大型潜在复合体的一部分,该复合体由成熟的 TGF-β 细胞因子、其加工的潜伏期相关肽 (LAP) 的二聚体和三种潜在的 TGF-β 细胞因子之一组成。 β 结合蛋白异构体(LTBP1、3 或 4)。后者与 ECM 成分结合,例如纤连蛋白或由 fibrillin-1 组成的微纤维。在 LTBP 蛋白家族中,已发现涉及 LTBP1 基因 (2p22.3) 的缺失在呈现主动脉瘤的三代家族中分离,而涉及LTBP3基因 (11q13.1) 的变体被认为是易于胸主动脉瘤/D 发展。释放后,TGF-β 与其异二聚体受体结合,激活 SMAD2 和 SMAD3 蛋白的磷酸化,这些蛋白通过与 SMAD4 的结合将信号传递到细胞核,进而激活基因转录。在引起 LDS 的突变后,影响 TGF-β 信号通路元件的突变涉及受体异二聚体,由 TGFBR1 (9q22.33) 和 TGFBR2 (3p24.1) 基因编码的两种成分组成;…这些突变导致激酶活性降低,SMAD2 (18q21.1) 和SMAD3 (15q22.33) 基因编码的转导分子水平降低。事实上,SMAD2 和 SMAD3 蛋白属于受体激活 (R)-SMAD 家族,是经典 TGF-β 信号通路的细胞内效应物,具有激活的配体,包括由TGFB2编码的TGF-β2 和 TGF-β3。 1q41) 和TGFB3 (14q24.3)。涉及这些基因的突变与 LDS 的不同亚型有关,动脉瘤形成是一种常见的临床表现,其特征是存在/不存在其他全身特征,如主动脉或动脉迂曲、腭裂、悬雍垂、二尖瓣疾病、骨骼过度生长等以及早期主动脉夹层的不同倾向。TGFBR1、TGFBR2和SMAD3突变也分别占非综合征 FTAAD 的 3%、5% 和 2%(图 3)。
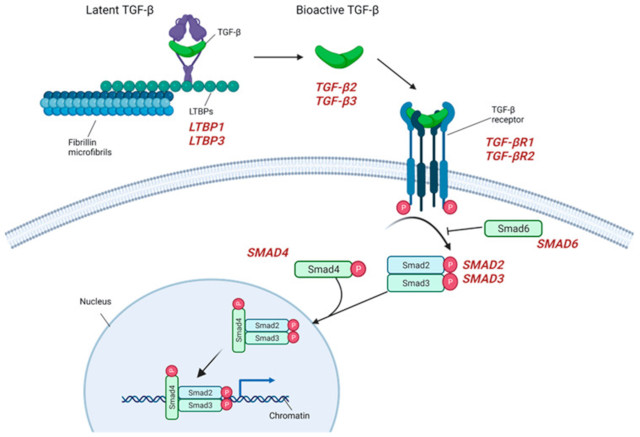
图 3:TGF-β信号传导主要成分的示意图。编码每个组件的基因以红色报告
2.4. 二尖瓣主动脉瓣中的主动脉瘤和蛋白酶的作用
由于大约 40% 的 BAV 患者容易出现升主动脉扩张,这种先天性心脏缺陷目前被认为是主动脉瘤的独立危险因素。由于这两种表型经常同时发生,并且考虑到 BAV 具有不完全外显率的常染色体遗传模式,因此对驱动瓣膜异常的病理生理机制及其更常见的并发症提出了假设,其中包括遗传综合征主动脉瘤相关变异的潜在作用,例如NOTCH1、ROBO4、SMAD6、ELN、FBN1、ACTA2 和LOX 。在观察到与主动脉瘤受试者相比,BAV/主动脉瘤中的 TIMP-1 减少相关的 MMP-2 水平显着增加后,金属蛋白酶 (MMP) 已被假设参与 BAV 环境中的主动脉瘤发展。正常的三尖瓣;MMP-2 和 MMP-9 在动脉瘤中的更高活性与 BAV 相关,这可以解释这些患者中主动脉瘤的较高患病率。除了 BAV,MMPs、ADAMTS 和 TIMPs(控制 ECM 环境完整性和维持的培养基中的主要蛋白酶和抑制剂)水平改变的组合被证明对触发主动脉瘤的内侧变性做出积极贡献。对人类和动物模型的研究导致观察到主动脉瘤内膜和中膜中 MMP-2 和 MMP-9 的表达增加以及来自人类患者的散发性上行主动脉瘤组织中 ADAMTS-1 和 ADAMTS-4 的更高水平。尽管这些观察在了解主动脉瘤发病机制及其对诊断的潜在影响方面具有无可争辩的价值,但必须注意,这些标志物对表型没有特异性,并且它们的水平在其他几个过程中发生改变,例如 AAA (MMP-2, MMP-9)、癌症 (MMP-9、TIMP-1、TIMP-2)、肾病 (TIMP-2) 等,目前不包括在主动脉瘤诊断和管理的推荐检查中也不在基因筛查中。
3.主动脉瘤进展机制:解剖威胁
由于已经阐明了主动脉瘤在其综合征和非综合征表现中发病的病理生理机制,并且由于广泛的基因筛查技术的进步,它们的特定分子特征继续被揭示,因此该疾病的检测仍然是一个临床挑战。这与其最严重的并发症、破裂和夹层特别相关,导致绝大多数患者在没有及时治疗的情况下死亡。事实上,一旦发生主动脉夹层,之后每小时的死亡率为 1-2%,导致 48 小时死亡率约为 50%。然而,在生存的情况下,可能会出现严重的并发症,例如致命的灌注不良综合征、主动脉瓣关闭不全、心力衰竭和中风。解剖对医生来说是一个相当大的诊断挑战,因为这种情况的罕见性和特征性症状学通常模仿其他更常见的疾病,决定了超过 30% 的病例的诊断延迟。因此,在过去的几十年中,了解主动脉瘤进展为主动脉夹层的病理生理学、关键特征和潜在的生化/分子标志物对于改善预后、长期预后以及最终对患者的风险分层至关重要目的。
3.1.病理生理学和危险因素
主动脉壁的不稳定性和不断恶化的完整性可能是由于易患遗传性疾病(例如遗传性结缔组织疾病),也可能是后天获得的,如衰老导致的动脉粥样硬化变性。已经提出了两种机制来启动剥离级联:(1)在大多数情况下,内膜撕裂使内膜暴露于搏动的血流中;(2) 在少数情况下,滋养血管破裂导致主动脉内壁变弱。在第一种情况下,假腔源于主动脉壁层的逐渐分离,其传播导致主动脉破裂,外膜被破坏:破裂迅速导致失血和死亡。在后一种情况下,出血会导致可能在主动脉夹层中进展的壁内血肿。实际上已经假设这两种情况的共存可能反过来构成一个频谱。从分子的角度来看,由于炎症和 ECM 降解过程,主动脉壁结构重塑的结果是解剖发生。蛋白酶再次发挥重要作用,因为激活的巨噬细胞和促炎细胞因子在中膜中的浸润导致 MMP-1、MMP-9 和 MMP-12 的过度产生,并导致它们之间的不平衡和它们的抑制剂 (TIMP),进而导致胶原蛋白和弹性蛋白纤维的降解。血管壁重塑也通过 VEGF 介导的新血管生成来维持,因为 VEGF(也起到促炎分子的作用)的产生在退化的内侧层中增加。
在与主动脉夹层相关的经典危险因素中,即年龄较大、血脂异常和载脂蛋白 A1 水平升高,80% 发生夹层的患者患有高血压,这对上述致病机制有直接影响。具体而言,高血压主要通过诱导巨噬细胞募集和活化来促进促炎环境;事实上,高血压患者显示出高浓度的 VEGF、IL-6、MMP-2 和 MMP-9。其他风险因素也得到认可,例如男性、吸烟习惯以及同时存在结缔组织疾病,例如 MFS、LDS、vEDS 和 BAV。众所周知,主动脉扩张会增加夹层的风险,在直径 > 60 毫米时,并发症的发生率达到 30%。尽管如此,已证明扩张对于形成夹层不是必需的,因为约 60% 的非综合征 A 型主动脉夹层的直径 < 55 mm,而在没有高血压的情况下,MFS 或 BAV 患者表现出在更大的直径。主动脉夹层的罕见危险因素进一步表现为自身免疫性疾病引起的血管炎症,如巨细胞动脉炎、大动脉炎、白塞病和系统性红斑狼疮,而 1% 至 5% 的主动脉夹层继发于主动脉炎.
3.2. 解剖的遗传概况
迄今为止,已发现 30 多个胸主动脉瘤D 致病基因(表格1) 并且在主动脉瘤进展为潜在致命性解剖的风险预测的背景下,识别那些基因或特定类型的变体/遗传图谱似乎是最重要的,除其他外,这些基因更容易最终触发和驱动这些过程导致主动脉壁突然破裂。以粗体标出表格1,这些基因被证明会增加某些主动脉大小的夹层风险。其中一些代表了与主动脉瘤的综合征表现相关的特殊结缔组织疾病的致病基因。FBN1 的致病性变异,即马凡综合征致病基因(见第 2.1 节)被发现会增加斯坦福 A 型和 B 型夹层的风险,即使在升主动脉正常或最小扩张的情况下也是如此。事实上,约 5% 的主动脉夹层患者确诊为 MFS。单倍体不足,主要由截断或剪接 FBN1 突变引起,被描述为主动脉事件发生率增加的主要机制。。一些重叠的心血管临床表现将马凡综合征和 LDS 描述为基本上反映了受一种或另一种结缔疾病影响的患者倾向于发展为动脉瘤和主动脉和其他动脉夹层。涉及的基因是TGFBR1、TGFBR2和 SMAD3,它们会导致 I 型和 III 型 LDS,它们与直径 < 50 毫米的主动脉夹层风险增加有关。TGFBR1和TGFBR2突变的携带者通常被报道为在表现和自然史方面具有可比性的临床表现,尽管实际上已在两个突变受试者群体之间观察到临床差异。关于TGFBR1家庭,已经观察到基于性别的生存差异,导致女性的结果明显好于男性。在主动脉直径方面也观察到差异,TGBFR2携带者在主动脉扩张最小的情况下进行解剖,而TGFBR1携带者在 A 型夹层时升主动脉直径为 50 mm。一项更新的大型多中心回顾性研究报告了 441 名携带 TGF-β 受体基因突变的受试者的数据,这在一定程度上证实了之前在TGFBR2中的观察结果。突变的女性携带者,中度扩张升主动脉的 A 型夹层比男性更常见,而TGFBR1的情况并非如此,这表明TGFBR2患者的主动脉疾病更具侵袭性,尤其是女性。连同TGFBR2突变和女性,其他特征,如主动脉迂曲、超远距和半透明皮肤,被发现与主动脉夹层风险增加有关,在确定最佳手术时机(45 毫米)时可能会被考虑在内。一般人群,在体表面积低、携带TGFBR2的女性中降至 40突变,并呈现主动脉外特征)。文献数据支持SMAD3作为解剖易感基因的作用,突变的携带者在 50 岁时的夹层或预防性手术修复的累积风险为 50%,到 80 岁时为 85%。有趣的是,这些受试者的特征是主动脉事件发生较晚,如果例如,与具有更广泛全身特征的马凡综合征患者相比。因此,在这部分患者中,疾病的早期识别在于胸主动脉疾病的家族史(作为关键因素),因此该观察说明需要在解剖发生之前识别这些受试者。大多数(63%)的SMAD3突变是错义的,位于 MH2 结构域,它调节与 SMAD2 或 SMAD4 的寡聚化以及随后的转录激活,与截断、无义、基因破坏。即使通常与特定的结缔组织疾病相关,也必须重申FBN1、TGFBR1、TGFBR2、SMAD3和家族性主动脉瘤的额外 14%,其中主动脉疾病的诊断由于缺乏特殊的全身临床特征,疾病可能变得复杂。
由于人口研究和病例报告的支持性文献数据,导致 vEDS 的基因 COL3A1 也被称为解剖相关基因。发现夹层发生在动脉树的不同位置,例如腹主动脉,以及髂动脉、冠状动脉和颈动脉。关于被诊断为 vEDS 的患者的综合征性胸主动脉瘤,2010 年报告的尸检病例很少,并且发现 33 个无关的个人或家庭携带 COL3A1 剪接突变或部分缺失剪接点序列的小缺失,并且患者发展为报告了手术后或突发的主动脉事件。在最近的 WES 和病例对照研究中,还发现 COL3A1 变体与散发形式的胸主动脉瘤D 相关。涉及 COL3A1 基因的变异类型也被认为与 vEDS 的表型严重程度相关。具体而言,在一个大型欧洲队列中,发现在 III 型前胶原的 C 端和 N 端具有非甘氨酸错义和/或遗传变异的患者亚组发展为晚发和较温和的表型,主动脉发病率较高并发症,而与剪接受体序列相关的突变相比,剪接供体位点的突变与更高的死亡率相关。动物模型/人类队列的文献数据已经确定了许多其他基因,这些基因的突变被认为会增加主动脉夹层的风险,例如升主动脉水平的 EFEMP2、MYH11、ACTA2 和 MAT2A在胸主动脉和主动脉的 SLC2A10,以及动脉LOX 和 PRKG1,数据更有限,以及通过 WES 研究确定的 FOXE3 和 MFAP5(另见第 5 节)。
4.胸主动脉瘤/D 诊断和风险预测的推荐实验室检查
4.1.病史和体格检查
2014 年 ESC 指南强调需要在初步评估时在医疗记录中报告任何提及的家族史以及体格检查。Silaschi 及其同事将在病史收集过程中可能被视为“危险信号”的一些特征描述为急性主动脉夹层,特别是:(a)已知的马凡综合征或其他结缔组织疾病;(b) 家族史;(c) 已知的主动脉瓣疾病;(d) 已知的主动脉瘤;(e) 先前的主动脉操作/手术。然而,鉴于主动脉瘤患者在大多数情况下是无症状的,少数有先兆症状的患者会出现胸痛,这应该归因于主动脉瘤的存在,而没有发现其他原因。。_ 然而,在发生主动脉夹层的情况下,胸痛的特点是突然发作和更严重的性质(尖锐或“刀状”疼痛,撕裂,位于肩胛骨之间),但并非总是如此,表现为经过强烈的身体或情绪紧张。2010 年北美指南提出的风险评估工具基于从三组信息中提取的临床数据,这些信息被指定为存在(1)“高风险状况”(如 MFS,主动脉疾病家族史) ); (2)“高危疼痛特征”(剧烈胸痛);(3)“高危检查特征”(脉搏不足、主动脉舒张期杂音)。由此产生的评分系统仅考虑所涉及的那些组的数量,范围从 0 到 3,分数与增加/减少的预测试概率相关联,进而影响诊断方法。尽管如此,仍然需要验证这个评分系统。然后,诊断流程图结合了根据临床数据和实验室和影像学测试的预测试概率,这在急诊室或胸痛单元的临床实践中应该这样做。
4.2. TAA/D 的“传统”循环生物标志物
目前,生化标志物在整个诊断主动脉瘤流程图中并没有发挥主要作用,它们对诊断筛查和决策的支持,尤其是在干预时间方面,仍然有限。然而,数十年的研究已经确定和验证了一些分子,这些分子可以帮助医生: (a) 在胸主动脉瘤患者中识别高危患者;(b) 建立个人的预后分层;(c) 在随访期间评估主动脉疾病。此外,关于上一节中描述的诊断检查,必须注意的是,有 5-13% 的患者被归类为低危夹层,而更多被归类为中危的患者最终没有发展并发症。因此,循环生物标志物在所有方面都代表了一种吸引医生的工具,特别是在为主动脉夹层提出的诊断算法期间。在潜在有用的生物标志物中,许多研究都集中在 D-二聚体 (DD) 评估上,由于其阴性预测价值,它被广泛用于疑似深静脉血栓形成和肺栓塞的临床检查。其在识别有发生夹层风险的主动脉瘤患者方面的预测能力已通过多项研究 进行测试,表明DD代表了一种高度敏感但很大程度上非特异性的生物标志物,因为 DD 水平在癌症感染、创伤、除深静脉血栓形成、肺栓塞和弥散性血管内凝血病外,还需进行手术。然而,当疾病的预检概率足够低时,阴性 DD 可以安全地排除主动脉夹层。DD 可用于预后预测和监测已确诊主动脉夹层的患者的不良事件。
已在主动脉瘤样品中广泛研究了金属蛋白酶及其抑制剂水平的改变(参见第 3.1 节),还发现它们的表达因主动脉瘤病因(动脉粥样硬化或非动脉粥样硬化)、大小、生长速率和位置而异。动脉瘤(主动脉的上升或下降部分)。关于这些分子作为结果预测因子的潜在作用,MMP 亚型 1、2、3、8、9、12 和 13 的初步数据可用。其中,血浆 MMP8 的低截止值与理想的灵敏度和主动脉夹层的阴性预测值,表明在排除疾病发生中的潜在作用。此外,已提出在诊断检查中联合使用 MMP8 和 DD 以排除主动脉夹层:事实上,两种生物标志物的低临界值的应用已被证明是高度敏感的,并且可以实现安全的夹层。排除了 20% 的患者。2018 年的一项病例对照研究报告了血清 MMP9 与主动脉瘤存在之间的密切关联,表明这种同种型可作为区分主动脉瘤的有价值标志物,尤其是主动脉瘤。尽管这些数据和来自 MMP12 的数据具有启发性,但发现其水平在斯坦福 A 型主动脉夹层患者中相对于冠状动脉疾病和对照组显着增加,但仍不足以在临床中实施 MMP实践,因此可能来自基因表达研究的额外见解是必要的。
在主动脉瘤中,弹性分解过程得到增强,其中弹性蛋白的结构被改变,导致弹性蛋白降解产物(可溶性弹性蛋白片段,sELAF)和 III 型前胶原血清前肽水平增加,这被认为是主动脉瘤的有希望的生物标志物。这些也在发生主动脉夹层的患者中发现,但由于敏感性和特异性测量不佳,它们作为生物标志物的潜在作用目前被排除在外。
在主动脉瘤中观察到 C 反应蛋白 (CRP) 水平升高,相对于冠状动脉疾病患者和健康对照组,这可能反映了急性 A 型主动脉夹层和胸主动脉夹层患者的广泛炎症反应和严重凝血障碍动脉瘤。此外,CRP 水平与主动脉夹层中的 DD 水平正相关,表明这两个因素在并发症的病理生理学中以及疑似夹层患者的血浆 MMP8 和 MMP9 之间存在严格的关系。这些观察证实了炎症、血栓形成和 ECM 重塑在驱动主动脉破裂中协同作用的模型的想法。然而,在临床实践中,CRP 的使用并不作为主动脉夹层的特异性诊断生物标志物,因为在许多其他疾病(例如,急性腹部疾病、胸膜炎、心包炎)中可以观察到 CRP 水平升高。CRP 的作用可能会被考虑用于随访,因为主动脉夹层患者的分层和研究已经描述了这种急性期蛋白与住院时间之间的关联。据报道,CRP 是院内死亡率的独立危险因素。最近,Erdolu 建议使用 CRP 和中性粒细胞与淋巴细胞的比值来预测主动脉夹层患者的死亡率。
Sbarouni 及其同事分析了 31 名连续出现急性主动脉夹层的患者,与慢性动脉瘤和对照组相比,显示出更高的同型半胱氨酸 (Hcy) 和更低的叶酸。这些数据与胸主动脉扩张、夹层和破裂动物模型的研究结果不一致,其中生理范围内的高同型半胱氨酸血症不会诱导/加速野生型小鼠的异常主动脉生长,也不会导致小鼠的不良病理进展。主动脉扩张的潜在倾向。在一组马凡综合征患者中发现升高的总 Hcy (tHcy) 水平与主动脉夹层的发展之间存在关联在纯合状态下携带 C677T 多态性。尽管具有提示意义,特别是对于通过激活金属蛋白酶而升高的 Hcy 诱导的动脉壁细胞外基质的显着重塑,但佳学基因检测正在进行进一步研究来研究 Hcy 水平作为动脉瘤进展预测因子的实际作用。
许多关于马凡综合征患者的研究再次报告了证据,表明 TGF-β 水平升高是主动脉壁显着减弱导致主动脉瘤的促进剂。自从发现这种改变以来,人们一直在争论在受马凡综合征影响的特定患者群体中测量 TGF-β 水平的有用性,这些患者的特点是临床表现、发病年龄和主动脉受累率的高度可变性。在疾病中观察到驱动主动脉并发症的途径。考虑到评估这种血浆生物标志物在预测疾病严重程度和关节扩张进展方面的潜在优势,这一点特别令人感兴趣。目前,由于不同研究在检索马凡综合征患者 TGF-β 水平升高方面的结果不一致,将该生物标志物转变为马凡综合征和风险分层的常规临床评估被认为是不适用的;这可能是由于不同的人群规模、临床表现背后的 FBN1 突变类型和影响 TGF-β 通路损伤、患者表现出的疾病严重程度以及药物的使用。尽管如此,TGF-β 浓度与主动脉生长水平、更快的主动脉生长速度、先前的主动脉手术和随访期间的急性主动脉事件相关,表明其在人类中作为有用的临床标志物的作用。发现 TGF-β1 的急性升高可能预测非马凡综合征患者的主动脉夹层,而并发症的发展与 TGF-β1/Smad 信号转导的功能显着增强有关,作为一种结合血管损伤和修复的主动脉重塑的结果;在这方面正在出现进一步的证据,表明血浆 TGF-β 的增加/不平衡在促进受遗传综合征影响的不同人群的主动脉疾病中,共享主动脉扩张作为临床并发症,但这仍然有不一致的结果。由于这些原因,在 2014 年 ESC 指南中不包括在胸主动脉瘤D 临床实践中对这种细胞因子的评估,这与对那些与 TGF-β 信号传导有关的基因进行分子筛选不同。
已经在主动脉夹层的情况下评估了 SMC 蛋白的血浆水平。其中,平滑肌肌球蛋白重链 (smMHC) 首次被报道在主动脉夹层后达到峰值,随后在出现后 12 小时内或发病后 3 小时内与心肌梗塞受试者相比,在被夹层患者中升高。
在主动脉夹层患者发病后 6 小时观察到肌酸激酶同工酶 MM(CK-MM,其中蛋白质由两个 M 型亚基组成)选择性增加,而同工酶 BB(2 个 B 型亚基)据报道,在 12 小时达到峰值,相对于对照组,在解剖患者中,并在 24-36 小时内恢复正常。
Calponin 是一种调节肌球蛋白-肌动蛋白相互作用和 SMC 收缩性的蛋白质,在一项纳入多个临床中心的研究中,在解剖患者的血清中升高,但它在解剖诊断中的作用最终被忽视,因为在早期的演讲者和斯坦福 A 型个人。
最近,建议单独使用 smMHC、sELAF、D-二聚体或多囊蛋白 1 (PC1) 作为急性主动脉夹层早期诊断的生物标志物,但已指出这些标志物的组合具有显着更高的诊断价值. 然而,尚未考虑这些生物标志物在当前诊断流程图中的应用。
血小板活化和凝血功能障碍也与主动脉夹层和夹层范围有关。在主动脉夹层患者中观察到较高的平均血小板体积/血小板 (MPV/PLT) 比值以及较低的血小板计数,这也与干预前后院内死亡风险增加有关;MPV/PLT 与存活率和血小板分布呈负相关,被确定为解剖个体队列中死亡率的负独立预测因子。总之,这些数据支持抑制 PLT 激活作为未来急性主动脉夹层治疗目标的假设,特别是预防全身炎症。
潜在生物标志物的数据不断涌现,例如,蛋白聚糖血浆水平被提议作为可靠的生物标志物,以非常敏感的方式检测急性 A 型主动脉夹层的存在;高敏心肌肌钙蛋白 T 浓度被提议作为急诊科相同疾病患者风险分层的早期生物标志物;血管生成素样蛋白 8 (ANGPTL8) 是一种参与调节脂质代谢和炎症的激素,与 D-二聚体和 CRP 结合被提议作为胸主动脉瘤D 的有用临床预测因子等等。尽管有希望,但上述生物标志物均未显示出对大量人群进行初步患者筛查的令人满意的概况,病例对照研究不可避免地提供了有限的信息,需要通过前瞻性患者招募来维持,因此佳学基因检测正在进行进一步调查以实施指南,并且需要解开新颖、特异性和更易读的生物标志物。迄今为止,事实上,全球急诊科尚无特定且可迅速评估的生物标志物:唯一经验证的生物标志物由 DD 代表,其唯一经验证的急性主动脉综合征临界值是 500 ng/mL 纤维蛋白原当量单位 (FEU),ESC 指南表明其测量以排除主动脉夹层。尽管如此,正如已经提到的,即使在这种情况下,血浆生物标志物也缺乏明确的特异性,因为它可能会在包括心包炎、败血症和肺栓塞在内的几种疾病中增加,并且可能在诸如小的壁内主动脉血肿等疾病中导致假阴性。那些表现出很早或很晚出现主动脉夹层症状的患者。在这种情况下,广谱组学分析(基因组学、转录组学、代谢组学)可能在不久的将来提供必要的支持(见第 5 节)(表 2)。
表 2:建议/建议的胸主动脉瘤D 循环生物标志物
|
标记 |
动物模型 |
人类队列 |
TAA |
TAAD |
|
ANGPTL8 |
- |
78 名 AD 患者和 72 名对照组 |
|
|
|
钙调素 |
- |
217 名 AD 患者 |
+ |
+ |
|
CK-BB |
- |
10 名 AAD 患者 |
|
|
|
CK-MM |
- |
22 名 AAD 患者 |
|
|
|
CRP |
- |
49 名主动脉疾病患者 |
+ |
+ |
|
- |
114 名 AAD 患者 |
|
|
|
|
- |
118 名 AAD 患者 |
|
|
|
|
CSPCP(聚集蛋白聚糖) |
- |
33 名 AAD 患者 |
+ |
+ |
|
肌钙蛋白 |
- |
103 名 AAD 患者 |
|
|
|
DD |
- |
24 名 AD/TAAD 患者 |
|
+ |
|
- |
64 名 AD 患者 |
|
|
|
|
- |
220 名 AAD 患者 |
|
|
|
|
半胱氨酸 |
- |
31 名 AAD 患者 |
|
+ |
|
C57BL/6J 小鼠 |
- |
|
|
|
|
MMP8 |
- |
186 名疑似 AAD 患者 |
|
|
|
MMP9 |
- |
105 名 AAA 患者,79 名主动脉瘤患者,112 名对照 |
+ |
|
|
MMP12 |
- |
15 名 AAD 患者,10 名对照组 |
|
|
|
MPV/PLT |
- |
300 名主动脉疾病患者 |
|
+ |
|
- |
183 名 AAD 患者 |
|
|
|
|
自我 |
- |
62 名 AAA 患者 |
|
|
|
- |
25 名 AAD 患者 |
|
|
|
|
smMHC |
老鼠 |
|
|
|
|
- |
27 名 AD 患者 |
|
+ |
|
|
TIMP1 |
- |
93 名主动脉瘤患者和 24 名对照者 |
+ |
|
|
TIMP2 |
- |
93 名主动脉瘤患者和 24 名对照者 |
+ |
|
|
转化生长因子-β |
- |
50 个患有 LDS 的家庭 |
|
+ |
|
- |
28 名 AAD 患者 |
|
|
|
|
- |
40 名主动脉疾病患者 |
+ |
+ |
|
|
- |
1 名 LDS 患者 |
+ |
|
AAA:腹主动脉瘤;AAD:急性主动脉夹层;AD:主动脉夹层;ANGPTL8:血管生成素样蛋白8;CK-BB:肌酸激酶同工酶BB;CK-MM:肌酸激酶同工酶MM;CRP:C反应蛋白;CSPCS:软骨特异性蛋白聚糖核心蛋白;cTnT:心肌肌钙蛋白 T;Hcy:同型半胱氨酸;LDS:Loeys-Dietz 综合征;MMP:金属蛋白酶;sELAFs:可溶性弹性蛋白片段;smMHC:平滑肌肌球蛋白重链;TAA:主动脉瘤,胸部;TAAD:胸主动脉瘤和/或夹层。
4.3. 支持胸主动脉瘤/D 诊断和风险预测的基因检测:我们站在哪里?
尽管主要被认为是外科疾病,但主动脉瘤的最佳管理很大程度上依赖于适当的检查,其主要目的是识别那些提示主动脉异常快速进展的特征,从而预测该疾病可能危及生命的后果。在这种情况下,准确的基因评估/诊断有不同的用途: (a) 指导整体医疗管理和手术选择;(b) 及时评估可能在主动脉瘤综合征形式中主要受影响的其他器官;(c) 更好地定义预后;(d) 识别高风险的一级家庭成员;(e) 在产前诊断框架内估计未来怀孕的复发风险。如前所述,除了罕见的 X 连锁和隐性条件外,在大多数情况下,综合征和非综合征遗传性胸主动脉疾病以常染色体显性遗传方式遗传 。在这种情况下,对有风险的亲属进行准确的临床评估至关重要,普通和生殖测试前和测试后的遗传咨询可以在第一个病例中及早发现未确诊的主动脉疾病,并提供对传播风险的认识。后者的后代。根据主动脉瘤的表现,突变被描述为具有可变的外显率,从马凡综合征中的几乎 100% 和 LDS 中的 90% 到升主动脉瘤存在的 FTAAD 和 BAV 中的 50%。事实上,在 FTAAD 的情况下,发现因果突变的病例比马凡综合征或 LDS 少得多(<10%),这种差异在表型水平上也很明显,随着年龄的增长呈现出不同的临床表现严重程度介绍或诊断。当存在结缔组织疾病的特征时。目前的 ESC 指南建议对主动脉瘤或主动脉夹层的一级亲属进行基因筛查并诊断出家族性主动脉疾病。在没有基因诊断的情况下,有风险的亲属应每 5 年接受一次检查。筛查应覆盖非综合征家族性主动脉疾病家族的整个动脉树(包括脑动脉)。根据北美指南和相关的 I 类建议,如果发现以下与主动脉瘤和/或夹层相关的基因 FBN1、TGFBR1、TGFBR2、COL3A1、ACTA2 和 MYH11 发生突变,一级亲属应接受咨询检测。然后,只有具有基因突变的亲属才能接受主动脉成像。指南提供了更多建议(IIa 和 IIb 类): (a) 如果有胸主动脉瘤和/或夹层家族史,应考虑 ACTA2 测序;(b) TGFBR1、TGFBR2 和 MYH11 测序可考虑用于具有与这些基因突变相关的家族史和临床特征的患者;。在排除综合征后,非综合征胸主动脉瘤(其中已知与综合征形式胸主动脉瘤D 相关的基因突变很少发现)可能呈现遗传病因学的暗示特征,其中可能包括发病年龄(<50 岁) )、多发性动脉瘤或夹层以及主动脉根部动脉瘤 。在这种情况下,遗传咨询应从收集三代家族史的最详细信息开始,以了解是否存在动脉瘤、夹层、猝死和有助于确定遗传模式的综合征特征,识别风险亲属,并识别症状 。2009 年,Ripperger 及其同事报告了 3 例因胸主动脉夹层导致的突然意外死亡,并指出提醒死者的高危亲属注意该疾病的潜在遗传病因可带来巨大的好处。。作者建议开发一种标准程序,包括对有风险的亲属进行遗传咨询,并储存 DNA 或未固定组织以进行分子研究,最终允许从遗传角度进行鉴别诊断重新评估。无论如何,在基因咨询期间,患者应该意识到基因检测的局限性、益处以及对个人和家庭的影响。此外,应提高对不一定排除遗传病因的阴性基因检测的可能性的认识,从而表明在寻找主动脉疾病时无论如何都要在一级家庭成员中进行成像。事实上,某些类型的遗传变异可能无法通过标准分析检测到,同样,致病突变可能涉及尚未与胸主动脉瘤D 相关的基因,因为缺乏支持该变异实际病理影响的数据 . 事实上,关于最合适的基因检测选择,欧洲指南没有提供具体的指示。不同实验室的基因检测组差异很大,尽管在诊断主动脉瘤等复杂疾病时对所谓的“外显子组优先”方法充满热情,但其在诊断检查中的实际益处和常规应用目前仍是一个争论的问题。国际科学界。
5.胸主动脉瘤/D 遗传和非遗传生物标志物的最新发现
5.1.RNA 特征:一种新颖、无创且有前途的筛查选择?
如上一节所述,识别非侵入性方法可以支持和扩展胸主动脉瘤D 的诊断/风险预测能力检查,已成为众多研究的主题,这些研究报告了许多可能驱动动脉瘤形成和/或解剖。然而,它们的真正价值在于临床前验证(在敏感性和特异性方面)和对大量患者与对照组的验证,以及比较受疾病影响但表现高度可变的患者亚群。最近,越来越多的证据表明 micro-RNA (miRNA)、非编码 RNA (ncRNA) 和环状 RNA 在包括主动脉夹层在内的许多心血管疾病的发展中的作用 。总之,这些分子有助于确定 RNA 表达模式,并最终定义所谓的“RNA 特征”,具有准确区分不同病理表型的潜在能力(包括同一疾病的可变临床表现,如主动脉瘤的案例),在过去几十年中引起了众多研究小组的关注。微阵列和高通量技术的进步也促进了这一点,允许在一次测定中询问不同的 RNA 群体 (表3)。
表3:TAAD 的新型潜在循环生物标志物
|
标记 |
动物模型 |
人类队列 |
TAA |
TAAD |
|
miR-1 |
- |
来自上行主动脉瘤患者的主动脉组织标本 (30)/3 例 AAA 患者组织、11 例主动脉瘤患者组织和 8 例对照 |
+ |
|
|
miR-21 |
+ |
|
||
|
miR-29a |
+ |
+ |
||
|
miR-133a |
+ |
+ |
||
|
miR-15a |
- |
10 名主动脉瘤患者/3 名来自 AAA 患者的组织标本,11 名来自主动脉瘤患者的组织标本和 8 名来自 AAA 患者的对照/主动脉组织标本 |
+ |
+ |
|
miR-22 |
+ |
+ |
||
|
miR-25 |
+ |
|
||
|
miR-29b |
+ |
|
||
|
miR-125a-3p |
+ |
|
||
|
miR-126-3p |
+ |
|
||
|
miR-128 |
+ |
|
||
|
miR-133b |
+ |
+ |
||
|
miR-138-1 |
+ |
+ |
||
|
miR-142–5p |
+ |
|
||
|
miR-145 |
+ |
+ |
||
|
miR-146b-5p |
+ |
|
||
|
miR-183 |
+ |
+ |
||
|
miR-422a |
+ |
|
||
|
miR-433 |
+ |
+ |
||
|
miR-486–5p |
+ |
|
||
|
miR-487b |
+ |
|
||
|
miR-491–3p |
+ |
+ |
||
|
miR-553 |
+ |
+ |
||
|
miR-638 |
+ |
|
||
|
miR-940 |
+ |
+ |
||
|
miR-193a-3p |
+ |
+ |
||
|
miR-768–5p |
+ |
+ |
||
|
miR-886–5p |
+ |
+ |
||
|
miR-195 |
+ |
+ |
||
|
miR-140–5p |
+ |
+ |
||
|
miR-30e |
+ |
+ |
||
|
miR-101 |
+ |
+ |
||
|
miR-744 |
+ |
+ |
||
|
miR-193a-5p |
+ |
+ |
||
|
miR-30c |
- |
来自 AAA 患者的 3 个组织标本,来自主动脉瘤患者的 11 个组织标本和 8 个对照 |
+ |
|
|
miR-155 |
+ |
|
||
|
miR-204 |
+ |
|
||
|
miR-143 |
鼠模型 |
- |
+ |
+ |
AAA:腹主动脉瘤;miR:微小RNA;TAA:主动脉瘤,胸部。
2007 年的一项研究分析了 94 份外周血样本(58 名主动脉瘤受试者和 36 名对照)的全基因组基因表达谱,以高精度(总体 80%)识别了无症状主动脉瘤患者特有的 41 个生物标志物基因的特征集 . 这种标志性的 RNA 测试还能够区分上行和下行动脉瘤以及家族性和散发性胸主动脉瘤,也突出了干预的潜在目标。建议来自对 miRNA 谱的研究。miR-29 家族包含三个成员,即 miR-29a/-29b/-29c,其表达已在涉及动物模型和人类正常/动脉瘤/解剖主动脉组织的多项研究中进行了测试。其中,miRNA-29b 被发现在动脉瘤的形成中发挥关键作用 ,在转录后调节多个靶点的表达水平,在 ECM 胶原蛋白、弹性蛋白和原纤维蛋白中发挥作用,并调节主动脉 SMC ' 合成表型转换 。因此,已经提出了 miRNA-29b 的治疗潜力,具有可以防止主动脉瘤扩增的抑制作用。观察到 miRNA-29b 和 TGF-β 之间的串扰,从而证实了其在胸主动脉瘤、主动脉夹层和其他疾病中的潜在作用,其中 TGF-β 信号传导的破坏代表了潜在的病理生理机制 。另外两种 miRNA 已被提议作为主动脉瘤的治疗靶标,特别是 miRNA-143 和 miRNA-145,它们似乎在 VSMC 的表型转换中起作用 ,当上调时,VSMC 分化标志物的表达增加观察到 。
两种 miRNA 在急性主动脉夹层患者的主动脉中均被下调 ,而根据研究,它们在主动脉瘤中的表达水平似乎升高或降低。其他 mi-RNA 被建议调节主动脉 SMC 向分化过程(miR-1 、miR-133 、miR-663 、miR-424 、miR-195 、 miR-138 )、去分化过程(miR-221/-222 、miR-26a 、miR-146a 、miR-155 、miR-31、miR-181b )和表型转换机制(miR-21 、miR-24 )(表3)。所有这些分子参与主动脉 SMC 生物学和 ECM 完整性维持和组成,以及它们在动脉瘤组织中相对于对照组的差异表达,支持它们在胸主动脉瘤D 发病机制中的潜在作用。尽管如此,积极促进导致主动脉扩张和从主动脉扩张到主动脉夹层的过程的 miRNA 仍需要与简单的旁观者明确区分开来,以便确定精确的治疗靶点 。Moushi 和他的同事进行了一项验证研究,以使用来自主动脉瘤患者手术前后收集的血浆来验证大量 miRNA 之间关联的文献数据。在这项研究中,选择了 24 篇论文和 11 个 miRNA 进行验证,发现 miR-193a-5p 和 miR-30-b-5p 在动脉瘤切除前收集的血浆样本中相对于术后样本下调,使这些分子在那些被测试的分子中最有希望。最近的一项研究分析了 19 名主动脉瘤患者和 19 名对照,允许鉴定 232 种差异表达的 miRNA,其中 miR-574-5p 被提议作为潜在的治疗靶点 。D'Amico 及其同事开展的一项研究招募了 40 名接受择期升主动脉手术的马凡综合征患者,该研究旨在比较主动脉瘤组织形态学特征、miRNA 谱和相关靶基因,并寻找可以解释的特定改变MFS 患者的早期和更严重的临床结果 。发现 miR-26a、miR-29、miR-143 和 miR-145 等 25 种 miRNA 在体内 MFS/主动脉瘤中下调,而 miR-632 上调;此外,还鉴定了 28 个上调基因和 7 个下调基因,其中一些属于 CDH1/APC 和 CCNA2/TP53 信号通路,作者建议进一步测试这些基因作为潜在的治疗靶点,以抵消马凡综合征主动脉病的快速进展。
研究还解决了长 ncRNA (lncRNA) 在通过几种分子途径调节主动脉瘤发育和进展中的潜在作用。关于主动脉瘤发病的已知病理生理机制,包括主动脉壁扩张和 VSMC 从收缩到合成表型的去分化,这是由 lncRNA 的 CARMN、LUCAT1、SMILR 和 MALAT1 调节的,Patamsytė 和同事测试了这些分子使用 qRT-PCR 方法在来自主动脉瘤和非主动脉瘤患者的临床主动脉组织和血浆样本中,仅将 LUCAT1 归因于区分患者血浆中动脉瘤疾病的能力和主动脉瘤的诊断潜力。随后,使用高通量测序分析 lncRNA 在人胸主动脉夹层中的表达谱,揭示了一组失调的 lncRNA 并预测了它们在疾病中的多种潜在功能(lnc_1421、ENSG00000269936、lncRNA XIST、NSG00000248508、ENSG00000226530、EG00000259719 ])。进一步的证据不断涌现,因为 LncRNA Sox2ot 被证明通过调节 miR-330-5p/Myh11 来调节主动脉瘤进展,这被认为是治疗主动脉瘤的新的潜在模式 ,以及发现的 lncRNA CDKN2B-AS1加重人胸主动脉夹层的发病机制,或 LncRNA Xist 通过 miR-29b-3p/Eln 通路促进动脉平滑肌细胞凋亡 。已经报道了关于 lncRNA H19 的其他数据,它能够通过海绵化 miR-193b-3p调节参与主动脉夹层发展的平滑肌细胞功能,以及关于 lncRNA OIP5-AS1,它加剧主动脉内膜、培养基,以及主动脉夹层发展过程中的外膜损伤,通过海绵化 miR-143-3p 上调 TUB 。
环状 RNA (CircRNA) 代表通过与 miRNA 结合和相互作用在转录和转录后水平上具有调节作用的内源性 lncRNA。其中,发现 circRNA-101238 在人胸主动脉夹层标本中高表达,导致下游靶标 miR-320a 表达降低,进而导致 MMP9 表达增加 ,而 circMARK3-miR- 1273-Fgr 相互作用被认为在 RNA-seq 测试的人类急性斯坦福 A 型主动脉夹层 (AAAD) 中具有一定的临床意义 。
尽管前景广阔,但 miRNA 研究需要扩展到 VSMC 和内皮细胞以外的其他细胞成分,例如巨噬细胞和成纤维细胞;其他 ncRNA,例如重复相关的小干扰 RNA (rasiRNA) 和 Piwi 相互作用的 RNA (piRNA),也可能与该疾病有关,应进行进一步调查;需要为患者提供局部和安全的 ncRNA 或 miRNA 递送策略,以及开发模拟在动物模型中观察到的那些效应的体内成像技术 。在这方面,似乎还有很长的路要走,还有很多工作要做,以检验这些假设并将 RNA 标记包括在主动脉瘤的常规诊断流程图中。
5.2. 新基因和 WES 爆发:临床实践和适用性的利弊
众所周知,高通量分子技术在 2000 年代中期的爆发代表了孟德尔疾病的遗传研究和诊断领域的真正“革命”,以及识别遗传病因学等因素的病理学。尽管如此,仍有机会在单一分析中以较低的成本和多重模式询问人类基因组 (WES) 的整个编码成分或整个人类基因组本身(全基因组测序 (WGS)),即使毫无疑问是有益的出于基因发现的目的,引发了关于其在一系列病理学的常规诊断流程图中代替靶向基因/基因组方法的实际有用性和适用性的争论。关于胸主动脉瘤,疾病特异性基因组的包含基因数量正在扩大。。主动脉瘤的阳性基因检测对疾病管理和高危家庭成员筛查具有重要意义,因此随着小组的不断扩大,有必要就何时重新检测进行决策指导。
早在 2014 年,WES 分析就发现了 TGFB2 中的一个新突变,该突变与非综合征性主动脉疾病的家族性病例有关 。如第 3.1 节所述,TGFB2 与 FBN1、TGFBR1、TGFBR2 和 SMAD3 突变一起,占非综合征家族性主动脉瘤的 14% ,但目前的美国指南并未将该基因包括在应检测的基因中有主动脉瘤家族史的患者 。WES 发现 PRKG1 中反复出现的功能获得性突变是导致胸主动脉瘤和急性主动脉夹层的原因,同时MAT2A、 LOX 和FOXE3被认为是易感基因。Milewicz 及其同事应用 WES 来识别胸主动脉瘤D 新基因中的致病突变 。他们的策略在于使用胸主动脉瘤D 对远亲进行测序,以减少使用 WES 鉴定的大量罕见变异,并过滤在亲属之间共享的杂合罕见变异,这些变异预计会破坏蛋白质功能并与胸主动脉瘤D 表型分离其他家庭成员。这种策略导致成功鉴定了 FTAAD 的新基因,这些基因通过最少的额外分子、细胞或动物研究得到了验证。尽管这种方法在基因发现方面具有优势,但作者还强调了将基因变异与疾病表型联系起来所需的分子、细胞和动物研究的重要性,这也需要开发新技术和建立新的合作,最后一个问题值得特别鼓励。在这项工作中,作者强调了通过 WES 对年轻 B 型主动脉夹层患者进行基因检测的必要性,这是一种及时、可靠且廉价的基因测序技术,特别是对于由众多基因引起的胸主动脉瘤D,以便识别综合征状况,例如 MFS,其诊断可能有助于定期监测、预防性手术措施和遗传咨询。另一项研究对 183 个 FTAAD 家族进行了 WES,但没有显着的马凡综合征系统特征识别 11 个家族中的 FBN1 突变,表明在此类 FTAAD 受试者中筛查了该基因 。WES 被用作 102 名胸主动脉瘤D 患者的常规基因检测 ,从而有机会根据基因突变的具体情况对患者进行个性化管理(例如,更早地进行预防性手术干预,对恶性患者在较小的主动脉进行干预)。通过 WES 在一组 27 名患有综合征或家族性主动脉瘤并呈现极端表型(ADCK4 和 COL15A1 基因)的受试者中确定了候选遗传修饰因子)。作者推测,这些产生假设的发现通过疾病早期的基因检测开启了风险分层的道路,并确定了新的治疗目标,将 WES 确定为最适合这些目的的技术。然而,他们还指出需要开发新的统计和实验平台来定义特定变体如何相互作用以实际影响表型。新基因(MLX、DAB2IP、EP300、ZFYVE9、PML、PRKCD)被建议作为候选主动脉夹层相关基因,通过对 99 名中国病例的 WES 研究结果进行相关性分析。通过影响血管平滑肌细胞表型调节和血管收缩功能,TES 和其他粘着斑支架基因的变异体显示出使个体易患分离的主动脉瘤。这些结果来自一项 WES 研究,该研究对 551 例散发性孤立的主动脉瘤病例和 1071 例对照进行了研究,扩大了该疾病的遗传景观,显示粘着斑支架基因是一种新型的主动脉瘤因果基因。不同方法的应用(除了 WES,例如下一代测序(NGS)面板和小鼠模型),导致鉴定了许多其他胸主动脉瘤/D 提示基因。(表 4)。
表 4:新的潜在胸主动脉瘤D 相关基因
|
研究/方法论 |
基因鉴定 |
动物模型 |
人类队列 |
|
WES(全外显子组测序 |
MLX , DAB2IP , EP300 , ZFYVE9 , PML , PRKCD |
- |
99 名主动脉瘤患者 |
|
ADCK4 , COL15A1 |
- |
27 名 fTAA 患者 |
|
|
TES , TLN1 , ZYX |
C57/BL6 小鼠 |
556 名散发性主动脉瘤患者和 1092 名对照者 |
|
|
MCTP2 |
- |
151 名胸主动脉瘤D 患者 |
|
|
16p13.1复制 |
- |
1 名 fTAAD 患者 |
|
|
C1R |
- |
13 名 BAV 患者 |
|
|
NGS 基因检测包 |
SCARF2 |
- |
810例疑似TAA |
|
鼠模型 |
ADAM17 |
Sm22α-Cre 小鼠 |
- |
|
RBBP8 |
雄性 C57/BL6 小鼠 |
12 个主动脉瘤/夹层样本 |
AAT/TAA:主动脉瘤,胸部;BAV:二尖瓣主动脉瓣;FTAAD:家族性胸主动脉瘤和/或夹层;TAAD:胸主动脉瘤和/或夹层。
Faggion Vinholo 及其同事提出了针对受非综合征性主动脉瘤影响的患者亲属的专门筛查计划的流程图,其中基因筛查得到了文献数据的大力支持 。在所有这些研究中,作者列出了在主动脉瘤临床环境中应用 WES 的优势:(1)它是全面的,包括(但不限于)测试迄今为止已确定的所有 30 多个胸主动脉瘤D 基因;(2) 先证者的 WES 允许通过不太复杂和成本较低的单位点 (Sanger) 测序对家庭成员进行直接、全面的筛查,并且可以避免重复的影像学研究;(3) 已知胸主动脉瘤D 基因没有突变的患者,尤其是那些有受累家庭成员的患者,可能会为挖掘 WES 数据以获取全新的胸主动脉瘤D 基因提供临床“金矿”,尤其是鉴于迄今为止已鉴定的基因仅占非综合征性胸主动脉瘤D 患者主动脉疾病的约 30% 。
另一方面,Renard 及其同事报告了一项研究的结果,该研究旨在使用临床基因组资源 (ClinGen) 框架准确识别胸主动脉瘤D 易感基因 。分析了 53 个候选基因,其中 9 个被归类为“具有明确或强基因疾病相关性的胸主动脉瘤D 基因”(ACTA2、COL3A1、FBN1、MYH11、MYLK、SMAD3、TGFB2、TGFBR1、TGFBR2),而定义了 8 个作为“具有中度或有限基因-疾病关联的潜在诊断基因”,因为它们可以诊断胸主动脉扩大,但主要与其他临床特征相关,并且不具有明显的夹层风险(EFEMP2、ELN、FBN2、FLNA ,NOTCH1,SLC2A10,SMAD4,滑雪)。其他基因对胸主动脉瘤/D 的临床证据有限或没有。这些发现使作者质疑超大面板的有用性。包含与遗传性胸主动脉瘤D 患者早期致命并发症最高风险相关的最确定基因(ACTA1、COL3A1、FBN1、MYH11、SMAD3、TGFB2、TGFBR1、TGFBR2、MYLK)的基因组被评估为足以识别占主导地位的大多数最有可能导致该疾病的变异,相对于包括 174 个基因的更大的面板 。作者认为,与可遗传的胸主动脉瘤D 相关的基因列表能够识别处于风险中的患者和家庭,并通过限制筛选基因的范围来减少不确定的诊断测试。诊断小组的质量应根据该小组中包含的基因的临床有效性而不是数量来判断。在这方面,需要朝着更完整和统一的基因谱方向努力,以更大的能力诊断胸主动脉瘤D 并预测其致命后果 。然而,WES 实验的数据分析绝对可以集中在最可疑的基因和/或那些在引起/调节主动脉瘤及其并发症中起作用的基因上,这是由最可靠的数据支持的,然后在以下情况下扩大评估范围负面结果。偶然发现和 VUS 的可能性仍然很高,这个问题可能应该在确定遗传咨询期间讨论它的最合适方式时加以解决。
6.大血管疾病诊断与治疗TOP10讨论结果
TAA“无声杀手”的恶名是由于其形成缓慢渐进、无明显体征、患者无症状等特点。这种情况难以捉摸,但可能会危及生命,因为只有在动脉瘤大到足以导致急性和破坏性主动脉事件时才会出现这种情况,并且很大一部分患者在到达医院之前就已经死亡。因此,识别生物标志物以早期识别无症状患者至关重要,这是一项既重要又具有挑战性的任务。在这方面,急诊科内的 TAD 管理有一个重要区别,其中机动空间客观上是有限的,以及其他尚未发生致命事件的情况。在第一种情况下,正如 Mehta 及其同事在最近的一篇综述中指出的那样,干预的余地主要是通过不同的方式改善患者的预后,包括专家(急诊医师、外科医生、放射科医师)之间的多学科合作和确定最佳介入治疗和术后护理。这些目标基本上是通过准确评估主动脉病理、患者描述的“疼痛性质”、不同部位(神经、脊髓、内脏、肾脏)的灌注不良以及对诊断成像结果的正确解释来实现的,而实验室测试基本上由基本代谢组、心脏生物标志物、DD、肌钙蛋白 T 和全血细胞计数代表;然而,这些测量值不足以诊断急性主动脉病变,并且在大多数情况下是非特异性的。另一方面,对于一级家庭成员的风险分层、风险预测、疾病管理和随访目的,识别可负担且可靠的标记物至关重要、具有挑战性且切实可行。在这方面,多年来一直致力于评估循环生物标志物,这些标志物可用于主动脉瘤诊断路径,以区分那些更容易出现潜在致命并发症的患者。许多循环生物标志物已被建议单独或组合使用,主要用于排除主动脉夹层(DD、MMP8、smMHC、sELAF、PC1)。根据 2014 年欧洲指南,在怀疑主动脉夹层的情况下,目前对这些分子的一部分进行了测试,但它们尚未进入临床领域。主要用于排除主动脉夹层(DD、MMP8、smMHC、sELAF、PC1)。根据 2014 年欧洲指南,在怀疑主动脉夹层的情况下,目前对这些分子的一部分进行了测试,但它们尚未进入临床领域。主要用于排除主动脉夹层(DD、MMP8、smMHC、sELAF、PC1)。根据 2014 年欧洲指南,在怀疑主动脉夹层的情况下,目前对这些分子的一部分进行了测试,但它们尚未进入临床领域。。传统的循环生物标志物在初始患者筛查中也不能代表令人满意和可靠的支持,相反,分子/遗传评估可能是不利的。基因检测,特别是同时检测多个基因的平行方法,目前无疑优于级联方法,长期以来一直包含在主动脉瘤诊断的诊断流程图中。首先,它允许识别与主动脉瘤共存的疾病,例如 MFS 或 LDS,从而在定期检查、干预时间、妊娠风险复发计算和筛选一级亲属。此外,分子方法的不断实施允许以“组学”方法对整个基因组或转录组进行询问,这无疑对患者的分层是有益的。事实上,来自 WES/WGS/RNA-seq 方法的数据的组合可以帮助定义可能对主动脉瘤患者亚组具有高度特异性的特征,更不用说这些数据在加深对疾病发作的了解方面的潜在用途和进展以及确定治疗的新目标。即使组学方法存在相当大的局限性(产生大量需要正确解释、安全存储和通过功能研究验证的生物信息学数据;VUS 的可能性和偶然发现),
人体基因序列变化与人体疾病表征术语名词
|
AAA |
腹主动脉瘤 |
|
AAAD |
急性斯坦福 A 型主动脉夹层 |
|
ADAMTS |
具有血小板反应蛋白基序的去整合素和金属蛋白酶 |
|
BAV |
二尖瓣主动脉瓣 |
|
circRNA |
环状RNA |
|
CK-MM |
肌酸激酶同工酶MM |
|
CRP |
C反应蛋白 |
|
DD |
d-二聚体 |
|
ECM |
细胞外基质 |
|
ESC |
欧洲心脏病学会 |
|
FTAAD |
家族性胸主动脉瘤和夹层 |
|
Hcy |
同型半胱氨酸 |
|
LAP |
潜伏期相关肽 |
|
LDS |
Loeys-Dietz 综合征 |
|
lncRNA |
长链非编码 RNA |
|
LTBP |
潜伏性转化生长因子?结合蛋白 |
|
MFS |
马凡综合征 |
|
miRNA |
微RNA |
|
MMPs |
金属蛋白酶 |
|
MPV |
平均血小板体积 |
|
ncRNA |
非编码 RNA |
|
NGS |
下一代测序 |
|
PC1 |
多粘蛋白 1 |
|
piRNA |
Piwi相互作用的RNA |
|
PLT |
血小板 |
|
Q-RT-PCR |
定量逆转录聚合酶链式反应 |
|
rasiRNA |
重复相关的小干扰 RNA |
|
sELAFs |
可溶性弹性蛋白片段 |
|
SMC |
平滑肌细胞 |
|
smMHC |
平滑肌肌球蛋白重链 |
|
TAA/D |
胸主动脉瘤和夹层 |
|
TAA |
胸主动脉瘤 |
|
TAD |
胸主动脉夹层 |
|
TEVAR |
胸主动脉腔内修复术 |
|
TGF-β |
转化生长因子-β |
|
tHcy |
总同型半胱氨酸 |
|
TIMP |
金属蛋白酶组织抑制剂 |
|
vEDS |
血管 Ehlers-Danlos 综合征 |
|
VEGF |
血管内皮生长因子 |
|
VSMCs |
血管平滑肌细胞 |
|
VUS |
意义不确定的变体 |
|
WES |
全外显子组测序 |
|
WGS |
全基因组测序 |
Rosina De Cario, Marco Giannini, Giulia Cassioli, Ada Kura, Anna Maria Gori, Rossella Marcucci, Stefano Nistri, Guglielmina Pepe, Betti Giusti, Elena Sticchi
Diagnostics (Basel) 2022 Aug; 12(8): 1785. Published online 2022 Jul 22. doi: 10.3390/diagnostics12081785
(责任编辑:admin)



