【佳学基因检测】采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测
遗传病、罕见病基因检测
精子症是一种与男性不育症相关的罕见精子形态异常,其特征是高比例的精子头部不规则。采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测的目的是确定导致巨精子症不育男性的基因原因。
采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测方法
用患者及其父母的外周血基因组 DNA 进行全外显子组测序 (WES)通过基因解码在众多突变体中找出致病基因突变。
采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测结果
来自近亲家庭的巨精子症患者进行 WES 分析后,可以在 AURKC 基因 (c.269G>A) 中鉴定出一个新的纯合错义变异体。生物信息学分析也表明这种变异是一种致病突变。定量实时 PCR 分析表明,与他的父亲相比,患者 AURKC 的 mRNA 水平显着降低。此外,ICSI 后无法移植胚胎。
采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测结论
些结果进一步支持 AURKC 在男性不育症中的重要作用,并指导医生为巨精子症患者做出最佳决策。
采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测关键词:
精子症,AURKC,辅助生殖技术,全外显子组测序
基因检测机构关于巨精症的介绍
球约有 7000 万对夫妇患有不孕症,其中约一半是由男性因素造成的。巨精子症是一种与男性不育症相关的罕见精子形态异常,其特征是高比例的精子头部不规则。这种综合征于 1977 年首次报道,影响不到 1% 的不育男性。它被认为是一种常染色体隐性遗传类型的畸形精子症,可导致男性不育。目前,已在巨精子症患者中发现的最相关的单基因缺陷是极光激酶 C ( AURKC ) 的突变。
AURKC基因编码高度保守的丝氨酸/苏氨酸激酶家族的成员,该家族在中心体功能、同源染色体分离和减数分裂期间的胞质分裂中起着至关重要的作用。到目前为止,只有五个AURKC突变被描述为与巨精子症相关:c.144delC (p.L499Wfs22)、c.744C>G (p.Y248*)、c686G>A (p.C229Y)、c.930 +38G>A(发生在 3′-UTR)和 c.436-2A>G(导致外显子 5 跳跃的剪接位点突变)。人类的这些突变导致蛋白质功能降低,导致减数分裂失败,但精子发生不受影响,导致大头精子的产生。
在这里,采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测报告了通过全外显子组测序鉴定的来自近亲家庭的不育男性的AURKC基因中的一种新型纯合错义变异。此外,根据基因解码分析,该变体具有很高的致病概率。还进行了 ICSI,但未能生成任何适合移植的胚胎。这些结果进一步支持了AURKC在男性不育症中的重要作用,并指导医生为巨精子症患者做出最佳决策。
材料和方法
病人
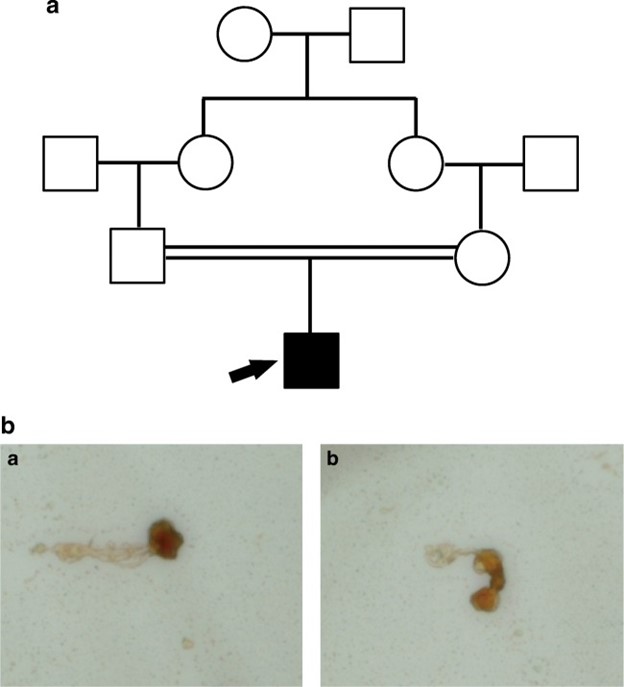
证者是一名在佳学基因合作医院接受不孕症治疗的 27 岁女性。患者丈夫的精液检查结果见表1。 结果显示,该患者患有巨精子症(接近 100% 的大头精子,精子数为 1 M/ml)。按照佳学基因不孕不育症标准问询表,得知患者丈夫的的父母为一级表亲(图 1)。患者表现出正常的勃起和射精,并报告每周性交 2-3 次;然而,他的妻子自2015年结婚以来一直无法怀孕。患者没有不健康的活动或接触不良化学物质的历史。体检示男性外生殖器发育正常,双侧睾丸大小正常,双侧精索静脉触诊无异常。先证者没有原发性小头畸形或呼吸道疾病。患者染色体核型正常(46;XY),Y染色体未见缺失。患者激素水平正常。
表1:患者射精的精子参数和形态
| 精子特征 | 病人 | 参考值 |
| 精子体积(毫升) | 1.8 | ≥ 1.5 |
| 每毫升数 spz × 10 6 | 1.71 | ≥ 15 |
| 大头 (%) | 96 | – |
| 精子尾部畸形 (%) | 83 | – |
| 动力 (%) (ab, 1 h) | 7.69 | ≥ 30 |
| 可行性 (%) | 15.4 | ≥ 55 |
| 正常 spz (%) | 4% | ≥ 15 |
基因组 DNA 提取和全外显子组测序 (WES)
据试剂盒生产者的方案,使用 QIAamp DNA blood midi 试剂盒(Qiagen,Hilden,Germany)从外周血样本中提取患者及其父母的基因组 DNA。
证者及其父母的基因组 DNA 接受了基于全基因组的的全外显子测序分析。全外子组基因测序基因检测由佳学基因在在 HiSeq2000 测序平台(Illumina,San Diego,CA,USA)上进行。移除序列接头后,使用 Burrows-Wheeler 比对器将全外显子组测序测序数据与参考基因组 Hg19 比对,然后移除 PCR 重复项。使用 SAMtools 识别包括单核苷酸多态性和插入缺失在内的变体,并通过 ANNOVAR 软件进行注释。候选基因被认为是满足以下标准的变体:(i) 错义、无意义、移码和剪接位点变体,(ii) 在两个数据库(dbSNP,1000G)中不存在或罕见(频率低于 1%), (iii) 患者的纯合子变异及其父母的杂合子变异。
Sanger测序验证
用 Sanger 测序验证了先证者及其父母的 AURKC 突变。我们使用特定引物(正向引物为 5'-AACCAGGATTCGAGTGTCTG-3',反向引物为 5'-CAATCTCCAGGTAGACGATGGAG-3')扩增 AURKC 基因外显子 3 的 PCR 产物。然后,在 ABI 3730XL 自动测序仪(Applied Biosystems,Forster City,CA,USA)上对 PCR 产物进行测序。
RNA提取和Q-PCR
用制造商的方案使用 TRI REAGENT® BD(分子研究中心)对全血进行 RNA 提取。用 5 μl 提取的 RNA 在患者及其父母身上进行逆转录。oligo-dT 的杂交通过在 42°C 下孵育 30 分钟并使用以下混合物在冰上淬灭来进行:5 μl RNA、10 μl 2Xsupermix(10 mM,Pharmacia)、1 μl gDNA(0.5 mM, Roche 诊断)和 4 μl H 2 O。然后使用 StepOne-PlusTM 实时 PCR 系统(Life Technologies)和 Power SYBR Green PCR,将 2 μl 获得的 cDNA 混合物用于定量 PCR(Q-PCR) Master Mix (Life Technologies) 根据制造商的协议。基因表达倍数变化的定量是通过相对定量法 (2−ΔΔCT ) 使用gapdh基因作为参考。数据显示为平均值的平均倍数增加标准误差。补充文件 1中描述了引物。
ICSI、胚胎和胚胎质量评价
患者及其妻子在佳学基因合作医院接受了胞浆内单精子注射(ICSI)。简而言之,根据试剂生产商的说明,使用 Vitrolife G-SERIES™ 培养基(Vitrolife,瑞典哥德堡)进行胚胎培养。患者的妻子接受了一个 ICSI 周期。“结果”部分描述了详细结果。
AURKC 蛋白的序列比对
用 ClustalX2.1 对不同物种的 AURKC 蛋白进行序列比对。每个物种的相应分子代码如下:Homo sapiens ( NP_001015878.1 ), Mus musculus ( AAI00338.1 ), Bos Taurus ( NP_001180124.1 ), Desmodus rotundus ( XP_024425801.1 ), Pan paniscus ( XP_003816716.1 ), Pongo abelii ( XP_002829903.1 ) 和褐家鼠( NP_001295465.1 )。
用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测结果
一例巨精子症患者的WES分析
了确定引起巨精症的来自基因序列变化的遗传原因,男性不孕症基因解码基因检测使用患者及其父母的外周血基因组 DNA 进行了男性不孕症致病基因鉴定基因解码基因检测,以确定可能存在的致病突变。考虑到血缘家族史,基因解码过程中首先关注纯合突变。在排除频繁基因突变和应用技术和生物过滤器之后,建立了有限的纯合突变列表。为了确定这 36 个基因中的任何一个是否与巨精症有关,基因解码首先检查了每个基因的组织表达模式。在这些纯合变异基因中,只有两个基因表现出睾丸富集表达。已鉴定的基因之一是 AURKC,基于基因解码的全外显子测序基因检测在患者的外显子 3 中鉴定出一个新突变(c.269G>A,GenBank 登录号,NM_001015878)。因此,氨基酸的变化被确定为Arg90Gln。另一个已鉴定的基因是配子发生素 ( GGN ) ,这个基因发生的突变是c.148T>C,GenBank 登录号,NM_152657.3。 在外显子 3 中被 WES 在患者中鉴定出来。因此,氨基酸的变化被确定为Trp50Arg。
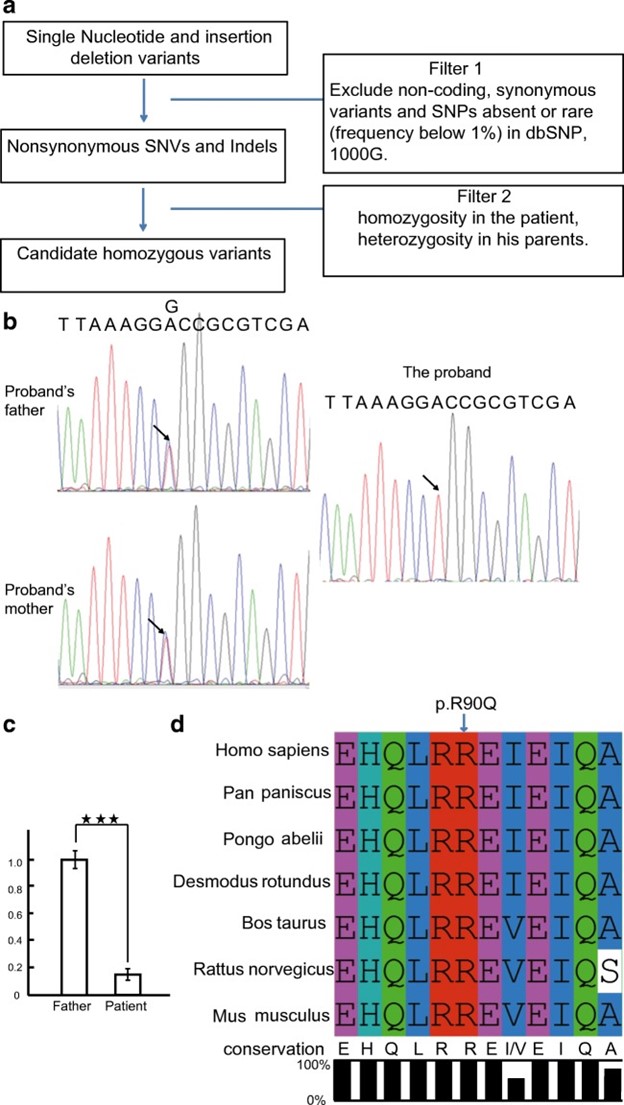
图 2:近亲家族的全外显子组测序分析。A本研究中使用的过滤策略。B受影响患者及其父母的 Sanger 测序验证。箭头表示突变位点。患者及其父亲AURKC mRNA 表达的C Q-PCR 分析。通过 Q-PCR 确定的信使 RNA 表达计算为相对于gapdh的比率,并相对于他的父亲表达。D不同物种中 AURKC 蛋白的序列比对。箭头指的是突变位点
通过 Sanger 测序验证
们接下来进行了 Sanger 测序,以验证患者及其父母AURKC和GGN基因的纯合变异。使用 PCR 从患者及其父母的基因组 DNA 中扩增AURKC基因的外显子 3 。AURKC中的纯合错义变异在该患者中得到验证,并且他的父母具有杂合等位基因(图 2B)。
AURKC中已识别变体的不利影响
幸的是,我们无法获得受影响患者及其父母的睾丸活检样本;因此,我们建立了 Q-PCR 来研究变异的影响。Q-PCR 分析表明,AURKC 的 mRNA 水平在患者中显着下调(图 2C)。
突变的计算机分析
过三种在线致病性预测工具(Polyphen-2、SIFT、Mutation taster)对 AURKC 基因中 c.269G>A 突变的生物信息学分析表明,该突变很可能是致病突变。此变体是 ExAC、1000G 和 gnomAD 数据库中不存在的新突变。R90 的突变位点从人类到斑马鱼高度保守,表明该位点对 AURKC 蛋白的功能具有重要作用(图 2D)。
CSI 使用患者的精子
密度梯度离心和仔细检查后,选择了一些适合 ICSI 微量移液器的“外观正常”的精子。在佳学基因检测合作医院为患者尝试了一个 ICSI 周期。对于 ICSI 周期,我们收集了 10 个卵子和 7 个 MII 卵母细胞;没有一个胚胎发育到胚泡阶段。
采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测讨论
过去十年中,五个突变(c.144delC (p.L49Wfs22)、c.744C>G (p.Y248*)、c686G>A (p.C229Y)、c.930+38G>A(发生在 3 ′-UTR) 和 c.436-2A>G(导致外显子 5) 跳跃的剪接位点突变)在AURKC基因中已被报道与巨精症有关。在这项研究中,我们在来自近亲家庭的患者的AURKC基因中发现了一个新的纯合突变 (c.269 G>A; p.R90Q) 。对患者进行了一个 ICSI 周期,但没有一个胚胎发育到囊胚阶段。
今为止,大量报告提供的证据表明,在第一次、第二次或两次减数分裂期间染色体分离和/或胞质分裂失败是巨精子症的主要原因 。Aurora 激酶是进化上高度保守的激酶,是减数分裂过程中准确的染色体分离和胞质分裂所必需的 。AURKC有 7 个外显子,编码人类 309 个氨基酸的蛋白质。AURKC是极光激酶家族的一个组成部分,主要在睾丸中表达。在采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测,佳学基因在AURKC的外显子 3 中发现了一个新的错义突变导致氨基酸变化的基因 (p.R90Q)。AURKC 蛋白的序列比对表明,该突变位点在不同物种中是保守的(图2C)。
用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测利用三种在线致病性预测工具(Polyphen-2、SIFT、Mutation taster)来预测该变异的危害性(表 2)。结果表明,该变异具有很高的致病概率。
前的研究比较了有和没有AURKC突变的患者的常规精液图和精细胞图的值。结果表明,大头精子的比例普遍达到了更高的值,1% 的正常精子的存在是AURKC突变患者中最具鉴别力的参数。与之前的研究一致,采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测中AURKC基因错义变异(c.269G>A)的患者显示 96% 的大头精子。然而,正常精子的比例达到了4%。一种解释可能是,除了巨精子症,这里研究的这名患者的精子数量也很低 (1.71 × 10 6). 操作员和实验室之间对正常精子特征的可变评分也可能影响结果,因为一些头部或鞭毛具有轻微形态缺陷的精子可以被认为是正常的。
多研究描述了巨精子症患者的妊娠失败。此外,进一步的研究建议,当患者头部精子增大超过 30% 时,应进行 AURKC 基因的系统遗传筛查。如果发现AURKC基因突变,则不应尝试 ICSI 。在这项研究中,患者的妻子在一个 ICSI 周期后未能怀孕,再次证明了AURKC与基因突变和 ICSI 结果。因此,不推荐对此类患者进行 ICSI。
之,采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测在 AURKC 基因中发现了一个新的错义突变 (c.269 G>A; p.R90Q)。迄今为止,这是与巨精子症相关的 AURKC 基因的第六个报告变体。采用全外显子组测序对不孕不育中的巨精子症进行致病基因鉴定基因检测扩大了 AURKC 突变的范围,有助于指导从业者为巨精子症患者做出最佳决策。



