【佳学基因检测】基因解码基因检测鉴别新型 TSHB 变异 (c.217A>C) 导致中枢性甲状腺功能减退和垂体增生
中枢性甲状腺功能减退及垂体增生的致病基因鉴定案例
促甲状腺激素 (TSH) 亚基 β 基因 (TSHB) 的双等位基因致病性突变导致孤立的 TSH 缺乏症和继发性甲状腺功能减退症,这是一种罕见的中枢性先天性甲状腺功能减退症 (CCH)。根据《内分泌系统基因检测及结果注释》,估计每 65 000 例新生儿中会有 1 例发生。它的特点是血液中游离甲状腺素水平低和血清 TSH 异常低,因此可能会在依赖于 TSH 升高的甲状腺功能减退症的常规新生儿筛查中被遗漏。甲状腺功能异常的基因解码基因检测团队描述了一名先天性甲状腺功能减退症患者,该患者因甲状腺素替代治疗依从性差而出现垂体增生复发和症状性甲状腺功能减退。她在新生儿时被诊断出患有 先天性甲状腺功能减退症,并且由于对甲状腺素替代的依从性不同,她在 17 岁时曾因与威胁性交叉受压相关的垂体增生而需要经蝶骨垂体切除术。 通过致病基因鉴定基因解码,在TSHB 的基因上发现了新的突变位点 c.217A>C, p.(Thr73Pro) 和数据库中已记录的基因突变 c.373delT, p.(Cys125Valfs*10) 构成复合杂合突变。成年后对治疗依从性的持续变化导致明显的垂体增生复发,随后随着依从性的提高而得到解决,无需额外的药物治疗或重复手术。该病例描述了一种通过致病基因鉴定基因解码而不是数据库比对发现的与先天性甲状腺功能减退症相关的新型 TSHB 变异,并证明了持续依从甲状腺素替代治疗甲状腺功能减退症和预防中枢性甲状腺功能减退症中垂体增生的重要性。
内分泌系统致病基因鉴定基因解码临床案例:
- TSH β 亚基基因 (TSHB) 的致病性变异是一个患者的中枢性先天性甲状腺功能减退症 (CCH) 的罕见原因。
- c.217A>C, p.(Thr73Pro) 是一种新的 TSHB 基因突变,在本病例报告中与先天性甲状腺功能减退症相关。
- 甲状腺素替代疗法对于预防临床甲状腺功能减退和垂体增生至关重要。
- 如果不坚持甲状腺素替代治疗,垂体增生可能会在手术后复发。
- 如果提高甲状腺素替代疗法的依从性以将游离甲状腺素 (FT4) 水平维持在中上正常范围内,而无需额外的药物或手术,垂体增生可以显着逆转。
中枢性先天性甲状腺功能减退症案例关键词
儿科,青少年,青年人,成人,女性,垂体,甲状腺,甲状腺, 遗传学,基因检测,神经病学,眼科,放射学,风湿病学,发病机制,治疗机制
中枢性先天性甲状腺功能减退症科普知识介绍
中枢性先天性甲状腺功能减退症 (CCH) 是一种罕见的甲状腺功能减退症。佳学基因对其进行的大数据统计为每 16 000-30 000 名活产儿中有 1 名罹患此病。先天性甲状腺功能减退症的特点是游离甲状腺素 (FT4) 水平低和血清促甲状腺激素 (TSH) 异常低。
由于垂体转录因子的突变,先天性甲状腺功能减退症通常与其他垂体激素缺乏有关。然而,导致继发性甲状腺功能减退的孤立性 TSH 缺乏症特别罕见 (OMIM: 275100),估计每 65 000 名新生儿中有 1 名患者。已知的遗传原因包括 TSH 亚基 β (TSHB; OMIM: 188540)、促甲状腺激素释放激素受体和免疫球蛋白超家族成员 1 (IGSF1) 的 TSH 信号基因缺陷。TSH 是糖蛋白激素家族的成员,该家族包括促黄体激素、促卵泡激素和人绒毛膜促性腺激素。它们都是共同的α亚基和亚型特异性β亚基的异二聚体,这决定了生物学特异性。因此, TSHB中的双等位基因病理突变导致严重的孤立性TSH缺乏。在本报告中,《内分泌系统疾病异常的基因检测》介绍了一名先天性甲状腺功能减退症患者,原因是TSHB中有两种复合杂合子致病变异,随后在不依从甲状腺素替代疗法的几个时期内发生了甲状腺素肥大。
中枢性甲状腺功能减退症临床案例的详细介绍
一名 31 岁的女性于 2013 年 10 月被转诊到佳学基因合作医院的内分泌科,继续治疗 TSH 缺乏的 先天性甲状腺功能减退症。在检查新生儿黄疸期间,她被诊断为新生儿 先天性甲状腺功能减退症。她的甲状腺功能测试显示总 T4 为 39 nmol/L(参考范围:126-214 nmol/L)和 RIA 无法测量的 TSH。垂体前叶和后叶功能检查其他方面均正常,脑 CT 未显示下丘脑或垂体异常。在整个婴儿期和儿童期完全替代甲状腺素后,她的成长和发育正常,并且得到了非近亲父母的良好支持。17 岁时,她接受了经蝶骨垂体切除术,以治疗与头痛和视交叉受压相关的垂体增生。回想起来,她承认,在她十几岁的时候,她对甲状腺素替代品的依从性不一。她继续进行甲状腺素替代治疗,否则手术后垂体摘除。
2013 年 10 月,由于对甲状腺素替代疗法的依从性不同,她出现了与甲状腺功能减退相关的肌肉疼痛、疲劳和头痛发作。当时,她每天服用 250 微克,但承认每周缺少 2-3 天的治疗。她没有服用其他药物。其他方面她都很好,并且报告月经规律。无内分泌疾病家族史。经检查,她的体重与之前的 78.8 公斤相比稳定。她处于窦性心律,血压为 95/60。甲状腺摸不着。视野正常。其余检查正常。
中枢性甲状腺功能减退症的临床症状分析调查
患者甲状腺功能明显减退,TSH 低(0.025 mIU/L;参考范围:0.40-3.50 mIU/L),游离 T4 低(FT4,6.5 pmol/L;参考范围:9.0-19.0 pmol/L),低游离 T3(FT3,<1.5 pmol/L;参考范围:2.6–6.0 pmol/L),与不坚持甲状腺素替代治疗一致。肌酸磷酸激酶 (CPK) 升高至 690 U/L(参考范围:29–168 U/L),与严重甲状腺功能减退相关的肌炎一致。催乳素在 616 mIU/L(参考范围:110-560 mIU/L)时略有升高,这可能发生在由促甲状腺激素释放激素 (TRH) 刺激引起的严重甲状腺功能减退症中。C反应蛋白正常(0.6 mg/L),除轻度嗜酸性粒细胞增多(0.5×10 9 /L)外,全血细胞计数正常。B12 和铁检查正常,乳糜泻血清学阴性。
MRI 垂体显示明显增生,延伸至鞍上方,但没有影响视神经交叉系统,垂体高度为 13 mm(图 1A和C)。
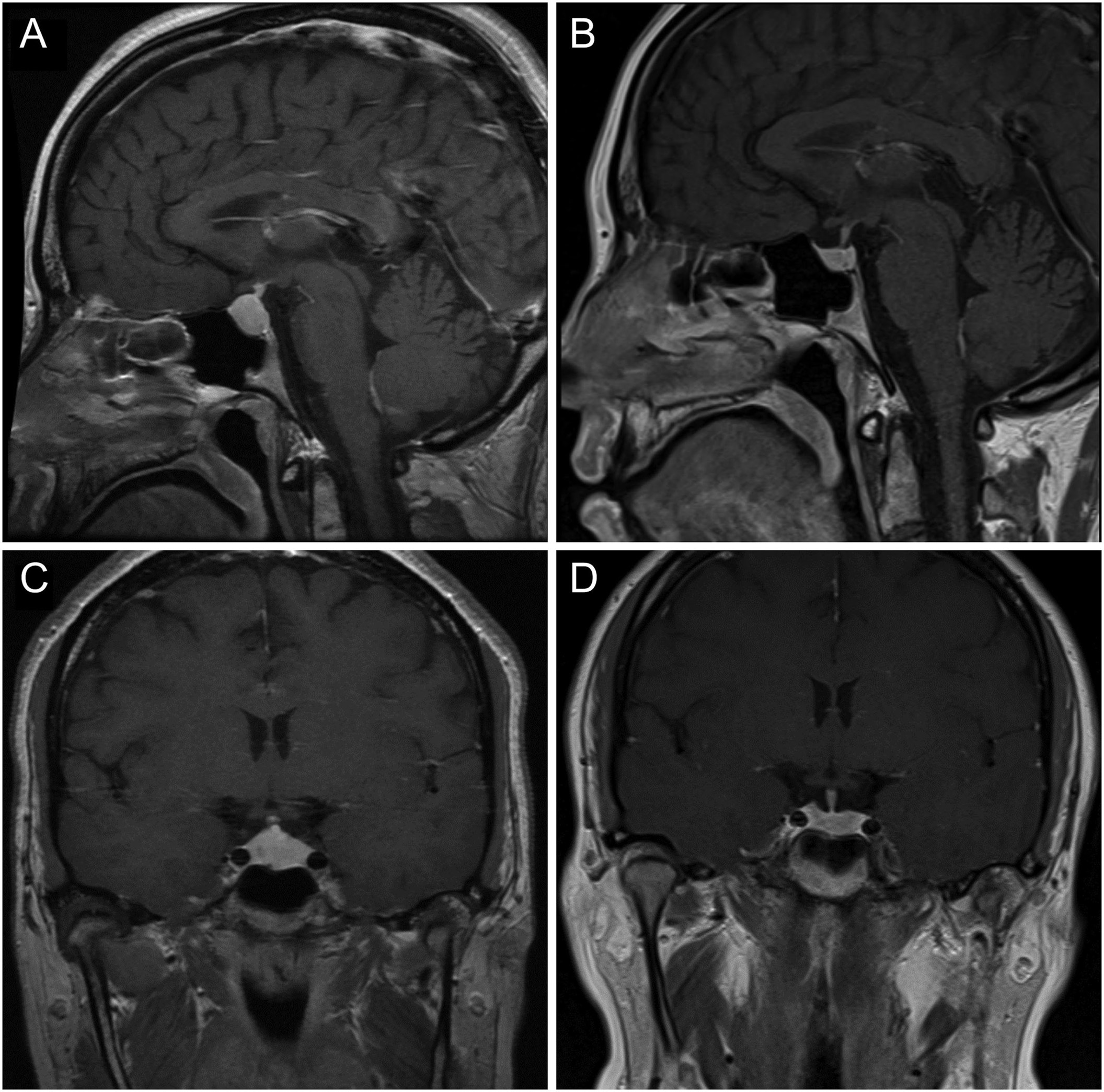
图1:2013 年 10 月(A 和 C)和 2017 年 6 月(B 和 D)的垂体窝横切和矢状切面的 T1 加权 MRI 图像(对比后)。在恢复一致的甲状腺素替代后,垂体大小明显减小。
为了确定她孤立的 TSH 缺乏症和先天性甲状腺功能减退症的原因,致病基因鉴定基因解码。Sanger 测序显示存在数据库中已经记录过基因突变位点 c.373delT, p.(Cys125Valfs*10) 和只有采用基因解码才能揭示的新的致病性基因突变位点 c.217A>C, p.(Thr73Pro)。经基因解码分析,两个突变位点形成复合杂合突变,形成疾病发生的基因原因(图 2)。使用 HomoloGene 分析包括 Thr73 在内的区域的 TSHB 蛋白序列同源性。该区域在物种间高度保守,Thr73 及其两侧的四个氨基酸在褐家鼠中是保守的,而苏氨酸本身在斑马鱼中是保守的(图 3)。
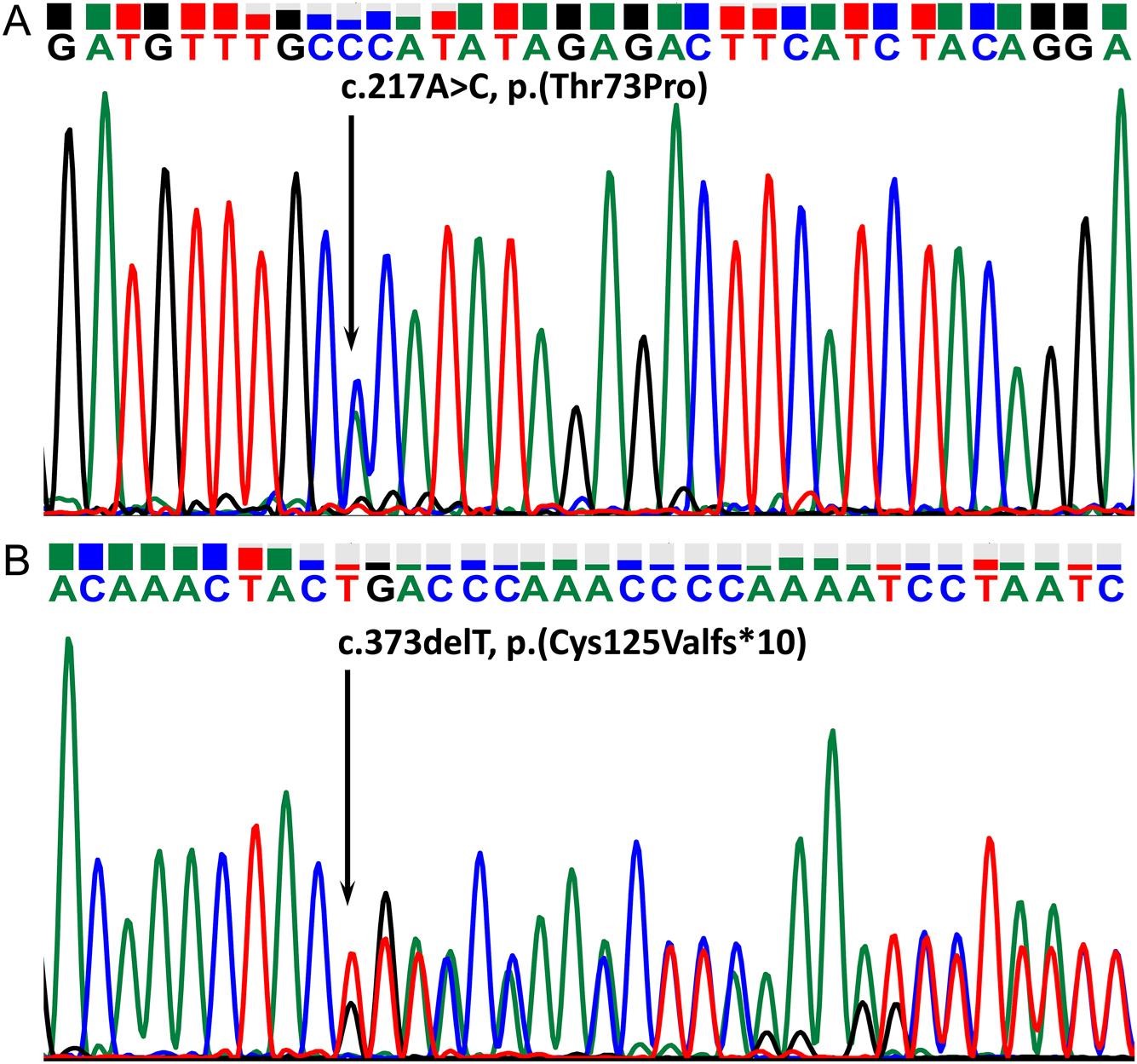
图 2:复合杂合先证者中TSHB外显子 2 变异体的电泳图。(A) 单核苷酸碱基错义变体,(B) 单核苷酸缺失无义变体。
处苏氨酸周围 TSHB 氨基酸序列的比较.jpg)
图 3:Euteleostomi 中密码子 73(粗体)处苏氨酸周围 TSHB 氨基酸序列的比较。α使用 HomoloGene (NCBI) 创建,列在减少人类 DNA 相似性 ( Homo sapiens ) 中。氨基酸序列侧翼的β数字代表密码子位置。
MutationTaster2021 用于评估本地基因序列的保守性。建议对两种突变进行保守,c.217A>C 和 c.373delT 的 PhyloP 阳性评分分别为 1.221 和 3.647,PhastCons 评分均为 1 。使用计算机工具评估新变体 c.217A>C 中的氨基酸取代对蛋白质功能的影响,PROVEAN(得分:-5.50)和 SIFT(得分:0.001)预测表明这种变化将是有害的或破坏性的,分别。
中枢性先天性甲状腺功能减退症基因检测指导下的有效治疗
建议她严格遵守甲状腺素替代疗法(每天 250 µg)。对患者进行教育,重点是遵守甲状腺素替代疗法、充分发挥甲状腺激素作用和防止垂体进一步增大的重要性。
靶向药物临床治疗结果及后续方案
患者在 7 个月后于 2014 年 5 月和 2017 年 6 月再次进行常规随访。在改善甲状腺素依从性后,她的肌肉疼痛在 2014 年得到缓解,CPK 正常化(35 U/L),其他情况下她处于身体健康。她保持正常的月经周期,尽管她继续报告偶尔的中枢性头痛。
她现在坚持使用甲状腺素治疗,血清 FT4 从低于参考范围增加到略高于参考范围;血清 TSH 此后一直低于参考范围(图 4)。比较她的历史 TSH 和 FT4 测量值表明 TSH 没有上升,因为 FT4 从 2010 年 10 月到 2013 年 10 月下降,在内分泌系统疾病靶向药物治疗团队在本病例报告中描述的症状性甲状腺功能减退之前,表明 TSH 升高不是替代不足的可靠标志。
 激素血清浓度随时间变化.jpg)
图 4:患者的 TSH 和游离 T4 (FT4) 激素血清浓度随时间变化。TSH 测量值根据右侧 y 轴绘制,FT4 水平根据左侧 y 轴绘制。显示了 FT4 (9.0–19.0 pmol/L) 和 TSH (0.40–3.50 mIU/L) 的实验室参考范围。
2017 年 6 月重复进行垂体 MRI 成像,结果显示垂体大小正常(图 1B和D)。血液结果还显示催乳素正常化至 140 mIU/L(参考范围:110–560 mIU/L)。
中枢性先天性甲状腺功能减退症的基因检测及其指导下的治疗分析及共识
内分泌系统异常的基因检测及其靶向药物治疗团队通过致病基因鉴定基因解码技术找到了一名垂体增生、肌肉疼痛、疲劳和头痛发作的患者的致病基因突变。该患者体内存在一种新型复合杂合致病性TSHB变异 (c.217A>C),导致中枢性甲状腺功能减退和随后的促甲状腺激素增生。值得注意的是,该病例描述了由于一段时间不坚持甲状腺素替代治疗,手术切除后垂体增生复发的案例。
佳学基因解码揭示:TSHB是一个长度达到 4.5 kb 的基因,位于 1 号染色体 (1p13.2) 上,由 3 个外显子组成。外显子 2 和 3 编码 138 个氨基酸序列,包括 20 个 N 端氨基酸信号肽和 6 个氨基酸 C 端延伸,它们被切割产生成熟的 112 个氨基酸的 TSHB 蛋白。先天性甲状腺功能减退症 的发展需要TSHB中的双等位基因功能丧失,并遵循常染色体隐性遗传模式)。
迄今为止,国际基因检测数据中中已经报道了 14 种与先天性甲状腺功能减退症相关的TSHB基因突变位点,如图 5 所示。这些基因突变位点通常通过移码、无义或剪接位点突变后的显着截断或通过破坏由于 TSHB 的“安全带”区域中的错义突变导致的 TSH 二聚化来破坏 TSHB 功能,这涉及与 TSHA 形成多个二硫键。TSHB等位基因缺失和涉及信号肽序列的变体也与先天性甲状腺功能减退症有关。
 患者的TSHB变异总结.jpg)
图 5:中枢性先天性甲状腺功能减退症 (CCH) 患者的TSHB变异总结。(A) 图解说明文献和本病例报告中报道的致病性TSHB变异的大致位置(粗体);(B)在从 UniProt (SMR: P01222) 获取的 TSHB 蛋白的 3D 模型上,本病例报告中报道的TSHB变体中涉及的氨基酸的位置。核苷酸编号从 NCBI 参考序列 NM_000549.5 的翻译起始密码子 (ATG) 的腺嘌呤 (+1) 开始,包括 20 个氨基酸的信号肽。安全带区域被标记并描述了半胱氨酸 108 和半胱氨酸 125 之间的区域 。
c.373delT (p.(Cys125Valfs*10)) 基因突变位点(传统编号:c.313delT,p.C105Vfs114X)涉及核苷酸 373 处的胸腺嘧啶缺失,导致位于安全带中的关键 Cys125 处的半胱氨酸变为缬氨酸。基因解码的致病分析指出,这一突变位点通常与 Cys39 形成二硫键的区域,可能会损害与 TSHA 的二聚化 。产生的移码也会导致在第 134 位产生过早的终止密码子。它是最常报道的导致先天性甲状腺功能减退症的致病性变异,并且已在整个欧洲大陆、美洲和英国被发现。虽然许多TSHB变异在近亲家族中最常见,绝大多数 c.373delT 变异病例已在无关和非近亲家族中报告 ,并且单倍型分析表明具有单系起源的突变。值得注意的是,在 gnomAD(版本 3.1.2)中,该变体在欧洲(非芬兰)中以 0.0003088 的等位基因频率发现,并在 ClinVar 中列为致病/可能致病和高度可信的假定功能丧失。
先前已经报道了涉及 c.373delT 和第二种致病性变异的复合杂合子病例,导致先天性甲状腺功能减退症与 c.373delT 纯合子病例的严重程度相同 。在这里,内分泌系统的基因检测应用争取TOP团队介绍了一个新的 c.217A>C (p.(Thr73Pro)) 变体与 c.373delT 组合的患者,导致新生儿发病的 先天性甲状腺功能减退症,表明 c.217A>C 变体的致病性。预测到脯氨酸的错义变化会带来显着的构象变化,并且密码子 73 处的苏氨酸位于TSHB的高度保守区域内。根据美国医学遗传学和基因组学学会指南,内分泌系统疾病基因检测及注释团队对这种新变异的致病性评估是“可能致病”,基于人口数据库 (PM2) 中不存在该变异,在反式中检测到隐性疾病 (PM3) 的致病变异,多行计算证据支持有害影响 (PP3),并且患者表型为对疾病具有高度特异性(PP4)。
该病例证明了在与致病性TSHB变异相关的先天性甲状腺功能减退症中严格遵守甲状腺素治疗的重要性,不仅可以治疗甲状腺功能减退,还可以预防甲状腺激素增生。垂体增生是未经治疗的原发性甲状腺功能减退症的已知后遗症,下丘脑 TRH 产生过多会刺激甲状腺激素增生和可能的泌乳素增生。此外,放射学上明显的垂体增生已被描述为TSHB致病变异患者的先天性甲状腺功能减退症标志,可能是由于 TRH 浓度过高。然而,与原发性甲状腺功能减退不同的是,由于 TSH 产生受损,TSH 水平不能准确地用于评估甲状腺素替代治疗在继发性甲状腺功能减退症中的充分性,正如内分泌系统疾病的基因检测中心在本例中所证明的那样。重要的是,研究表明,与原发性甲状腺功能减退症患者相比,继发性甲状腺功能减退症患者甲状腺素替代不足的风险更高。为了提供足够的左旋甲状腺素,目前的指南建议,中枢性甲状腺功能减退症患者的游离 T4 水平应保持在正常的中上限值 。
该病例描述了复合杂合TSHB变体,包括新的 c.217A>C (p.(Thr73Pro)),导致 先天性甲状腺功能减退症,对甲状腺素替代的依从性不同,导致复发性垂体增生。该病例强调,即使在垂体手术后,足够的甲状腺素替代物对于预防先天性甲状腺功能减退症患者的促甲状腺激素增生也是必不可少的。



