【佳学基因检测】基因检测纯合子双胞胎的临床表型变异性及对治疗法方案的差异性
基因型与人体疾病表型的关系研究
背景:威尔逊病 (WD) 是一种铜沉积的常染色体隐性遗传疾病,由铜转运 ATP7B 基因的致病变异引起。在威尔逊病的症状表现方面,基因型和表型之间没有明确的相关性。遗传上相同的威尔逊病双胞胎具有表型不一致和对威尔逊病特异性治疗的不同反应行为的表现支持了这一点。病例介绍:其中一名女性纯合子双胞胎(年龄:26 岁)出现书写、说话、吞咽和行走障碍,导致住院检查没有确凿的结果,但建议进行基因检测。两姐妹都经过测试,C.2304dupC;p(Met769Hisf*26) 和 C.3207C>A;p(His1069Gln) 突变是杂合子。用 450 mg D-青霉胺 (DPA) 对受影响的兄弟姐妹进行自我药物治疗并不能防止进一步恶化。她患上了青少年帕金森综合症,并变成了坐轮椅并患有关节炎。应用经皮内窥镜胃造口术。她的无症状姐姐帮助她度过了日常生活。尽管严重受影响患者的 DPA 剂量立即增加(3 周内高达 1800 mg),并且在基因检测基因型与表型关系的研究课题组机构首次就诊后无症状患者开始 DPA 治疗(2 周内高达 600 mg),肝两名患者的功能测试进一步恶化。2个月后,帕金森病患者开始好转并再次行走,但经历了几次跌倒,右肩骨折,并接受了两次必要的手术干预。随着进一步的铜消除疗法,两名患者的肝功能障碍均得到改善,严重受影响的患者无需进行原位肝移植(LTX)。她的肝和脑功能障碍的良好恢复只是暂时中断了肾病综合征的发展,这种综合征在改用 Cuprior 后消失了®。不幸的是,她死于暴发性肺炎。结论:尽管遗传倾向相同,但单卵双胞胎的威尔逊病症状表现可能会有所不同,并且可能需要采用非常不同的治疗方案。到目前为止,潜在的基因 - 环境相互作用尚不清楚。
关键词: 同卵双胞胎,表观遗传机制,基因型-表型不一致
1. 威尔逊病基因检测简介
威尔逊病 (WD) 是一种铜代谢常染色体隐性遗传疾病,由位于 13 号染色体的大 ATP7B 基因缺陷引起,该基因包含 20 个内含子和 21 个外显子。在 ATP7B 中描述了超过 1000 个突变。 那些 ATP7B 突变和肝细胞中 ATP7B 转运蛋白的失活导致铜的胆汁排泄失败,从而导致铜稳态紊乱 。ATP7B 还负责运输铜以合成功能性铜蓝蛋白 。因此,WD 患者的血清铜蓝蛋白和总血清铜水平降低,毒性非铜蓝蛋白结合铜水平升高 。
毒性铜的肝脏和全身超负荷是许多不同器官的组织病理学和临床症状的主要原因,包括在威尔逊病症状表现的后期阶段中的中枢神经系统 (CNS) 。高水平的铜进入大脑 并主要影响灰质 的结构和功能,特别是在基底神经节、皮质和脑干核中。典型的临床神经系统表现是由这些不同的大脑结构的参与引起的 。
在不同的研究中尝试了寻找 ATP7B 基因型和威尔逊病表型之间相关性的挑战性任务,但没有取得多大成功 。表观遗传机制促成了这种基因型-表型不一致,并可能解释不同的症状谱。导致表观遗传修饰的不同触发因素的权重通常是未知的。然而,重要的是要识别它们以补充治疗方法、预防残疾和提高患者的生活质量 。
几个具有不同疾病表型的纯合威尔逊病双胞胎病例报告以及动物模型研究表明并支持表观遗传变化参与威尔逊病的发病机制及其表型表现,主要表明环境或营养因素可能影响威尔逊病。在这里,基因检测基因型与表型关系的研究课题组描述了另一对具有不同临床表现的单卵WD双胞胎,但与之前关于单卵WD双胞胎的报道相比,基因检测基因型与表型关系的研究课题组将更多地关注治疗和管理的困难,并展示疾病进程和治疗反应的差异。
2. 案例展示
2.1 首次访问基因检测基因型与表型关系的研究课题组机构之前的历史
这些同卵姐妹第一次来基因检测基因型与表型关系的研究课题组机构之前的历史总结在表1. 直到他们在 22 岁结婚之前,没有迹象表明姐妹 1 或姐妹 2 会患上神经系统疾病。
表1:第一次访问基因检测基因型与表型关系的研究课题组机构之前的姐妹 1 和 2 的历史
|
|
姐妹 1(严重受影响的双胞胎) |
姐妹 2(无症状双胞胎) |
|
居住 |
直到她22岁在父母家结婚 |
直到她22岁在父母家结婚 |
|
童年 |
正常里程碑 |
正常里程碑 |
|
学校 |
师范学校、职业培训 |
师范学校、职业培训 |
|
婚姻 |
婚后出现健康问题,2年后离婚,回娘家 |
与丈夫异地同住,婚后不久怀孕,生下健康儿子 |
|
疾病 |
出现震颤、书写、说话和吞咽困难以及步态障碍 |
保持健康 |
|
一般 |
怀疑有血色素沉着症,但肝活检尚无定论 |
NA |
|
神经 |
检测到正常腰椎穿刺 |
NA |
|
基因 |
C.2304dupC;p(Met769Hisf*26) & C.3207C>A;p(His1069Gln) 突变。 |
C.2304dupC;p(Met769Hisf*26) & C.3207C>A;p(His1069Gln) 突变 |
|
治疗 |
d-青霉胺 (DPA):300 毫克 |
不治疗 |
离婚后,姐姐 1 逐渐出现神经精神症状,这些症状最初被解释为心因性起源。然后,怀疑有血色素沉着症,并在三个月内进行了住院评估。最后,在进一步的神经住院评估中,由于存在 Kayser-Fleischer 环,诊断出 WD。开始使用 300 mg d-青霉胺 (DPA) 治疗,患者因基因检测的建议而被解雇,这证实了两姐妹的 WD。
2.2 首次访问基因检测基因型与表型关系的研究课题组机构后的历史
在姐妹 1 被诊断为威尔逊病后大约 4 个月的显着时间滞后,这两名患者最终以自己的方式出现在基因检测基因型与表型关系的研究课题组的机构中。
2.3 重度患者 1 号姐妹的病史
姐妹 1 已将 DPA 剂量增加到 450 毫克。然而,在过去的 4 个月里,她的病情迅速恶化。在第一次演讲中(图1),姐姐 1 几乎患有关节炎,吞咽严重困难,通过 PEG 应用得到补偿,患有严重的青少年帕金森综合征,运动相当缓慢,严重的站姿和步态共济失调,无法独自行走,依靠陪同人员或轮椅(图1)。此外,还有垂直凝视麻痹和流涎。未发现感觉异常或锥体束征。写作是不可能的。只有轻微的焦虑症,可能基于无助,没有智力缺陷的证据。
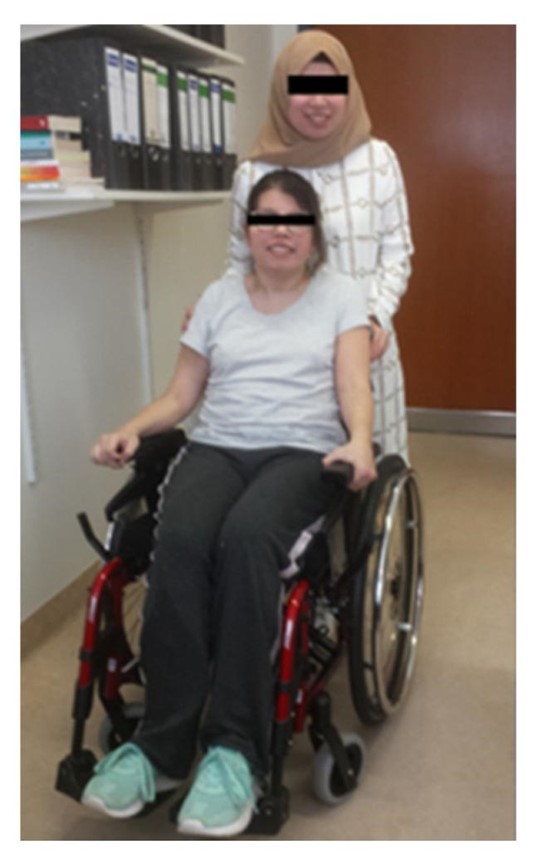
图1:这些纯合子双胞胎在临床上以完全不同的方式受到影响:一个姐妹坐在轮椅上,另一个姐妹没有症状。两名患者都对 DPA 治疗有反应,然而,严重受影响的患者在 DPA 治疗期间出现了肾病综合征。
由于症状严重,每日剂量在 3 周内从 450 mg/天增加到 600 mg DPA/天的 3 倍。最初,患者对 DPA 治疗反应良好;肝脏值显着改善,铜排泄量最初很高,然后按预期下降。神经系统症状开始好转。然后,大约 6 个月后,患者出现体重增加和呼吸困难,全身状况进一步恶化。神经系统症状的改善停滞不前。鉴于蛋白质排泄量倍增,诊断为DPA引起的药物副作用肾病综合征(图 2C(左侧;三角形))。通过将 1 片 DPA 更换为 1 片 Cuprior ® ,患者在 6 天内从 3 × 2 片 DPA 300 mg 转换为 3 × 2 片 Cuprior ® 150 mg 。这一转变后,蛋白质丢失和全身状况,特别是呼吸困难和神经系统症状进一步改善。图 2A,C(左侧))。
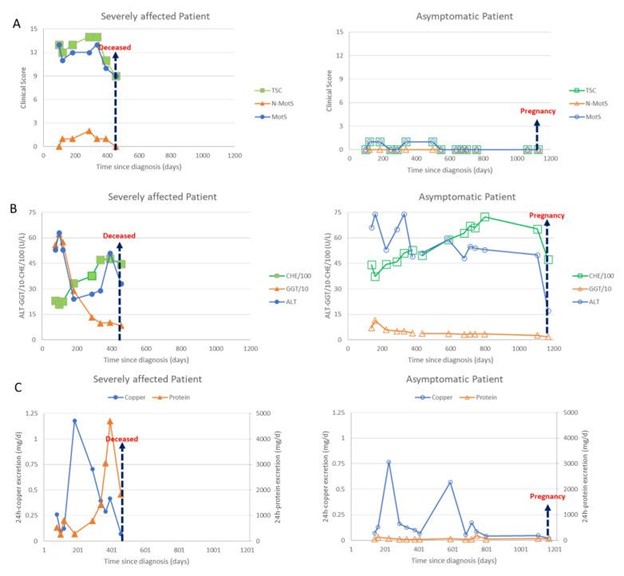
图 2:左侧(全符号)显示严重受影响患者的数据,右侧(空心符号)显示无症状患者的数据。箭头表示受严重影响的双胞胎死亡或无症状双胞胎的第二次怀孕。(A)在图 2呈现临床评分。在不到 10 个月的充分治疗后,运动评分(MotS;圆圈)、非运动评分(N-MotS;三角形)和总分(TS;正方形)明显改善(详见病例报告)。无症状患者的评分一直低于2分。(B)在图 2呈现B肝酶。丙氨酸氨基转移酶(ALT;圆圈)的值没有缩放,γ-谷氨酰转移酶(GGT;三角形)的值除以 10,假胆碱酯酶(CHE)的值除以 100。治疗开始后 100 天,两名患者的所有肝酶都开始改善。(C)在图 2C 显示了 24 小时尿液中铜(圆圈)和蛋白质(三角形)的每日排泄量。充分的铜螯合治疗大大增加了两名患者的每日铜排泄量。随着治疗时间的延长,24 h 铜排泄量缓慢下降。在用 DPA 充分治疗 7 个月后,由于肾病综合征,在姐妹 1 中观察到蛋白质排泄突然增加,这可以通过将药物从 DPA 转换为 Cuprior ®来停止。尽管出现了肾病综合征,但严重受影响的双胞胎的神经系统症状有所改善(比较图 2A,C(左侧))。姐姐去世后,无症状患者(右侧)中断服药,导致铜排泄出现第二次短暂高峰。
随着患者活动能力的提高——患者终于能够在没有帮助的情况下步行几步——不幸的是,她经历了一次摔倒,右侧肩部骨折,并因此进行了两次必要的手术,进一步延迟了神经功能的快速改善。此后,她可以进行长达两个月的长途旅行,探望祖父母。
在她返回后,患者出现发烧和咳嗽,并被送往周边医院。这发生在第三波 COVID-19 大流行的时候。据称,该患者的检测结果为阴性,但基因检测基因型与表型关系的研究课题组没有 COVID-19 检测结果的文件。由于患者自然死亡,没有进行尸检。在鉴别诊断中,尽管应用了经皮内窥镜胃造口术(PEG),支气管肺炎仍应被视为窒息死亡的原因。
2.4 受轻症患者 2 号姐妹的病史
在临床和神经学上,第二个姐妹在第一次就诊时没有症状(图1, 站立的人;图 2A,右侧)。她的体重不到50公斤。DPA 治疗开始并在 2 周内增加到 600 毫克。
尽管该患者在临床上没有症状,但她的肝脏值已经异常,在剂量增加的初始阶段甚至进一步恶化。然而,几周后,肝脏值有明显改善(图 2B,右侧)为准备怀孕,DPA 剂量增加到 1500 毫克。在妊娠试验阳性后,DPA 剂量减少到 300 毫克。在正在进行的螯合治疗和怀孕期间,她没有出现任何症状(图 2A,右侧)。
2.5. 1 号和 2 号姐妹的临床评分、肝酶、尿铜和蛋白质排泄表明 1 号姐妹出现肾病综合征
在每次访问中,姐妹俩都接受了详细的临床神经学检查。对七种运动症状(肌张力障碍、构音障碍、运动迟缓、震颤、步态障碍、动眼神经障碍、四肢共济失调)和三种非运动症状(反射异常、感觉症状、神经心理和精神症状)进行评分,以确定这些症状是否存在。不存在 (0) 或仅轻度 (1)、中度 (2) 或严重 (3) 存在。将运动评分相加得出威尔逊运动评分(MotS:0-21),将三个非运动项目相加得出非运动评分(N-MotS:0-9)和 MotS 的总和和 N-MotS 产生总分(TSC:0-30)。这些评分已在基因检测基因型与表型关系的研究课题组部门用于监测威尔逊病的治疗约 30 年 并且与意大利 Monotematica AISF 2000 OLT 研究组 中使用的分数相似。WD 患者只要 TSC <3 就被评分为轻度受影响,TSC 在 3 和 6 之间被评分为中度受影响,而 TSC >6 被评分为严重受影响。在图 2A,MotS(圆圈)、N-MotS(三角形)和 TSC(正方形)的时间发展呈现给左侧的姐妹 1 和右侧的姐妹 2。
在基因检测基因型与表型关系的研究课题组对威尔逊病的常规治疗监测期间确定的一长串实验室参数中,选择了以下参数来证明铜螯合疗法的疗效以及双胞胎对治疗的反应差异:肝酶 ALT(圆圈)、GGT(三角形)和 CHE(正方形)(图 2B) 和铜(圆圈)和蛋白质(三角形)的 24 小时尿排泄量(图 2C)。
2.6. 姐妹 1 和 2 的 cMRI-、OCT-、ARFI-、US-调查和 MELD-评分
两姐妹都接受了进一步检查,证实姐妹 1 的大脑和肝脏严重受损,而姐妹 2 的脑成像正常,肝脏轻度受累(图 3)。
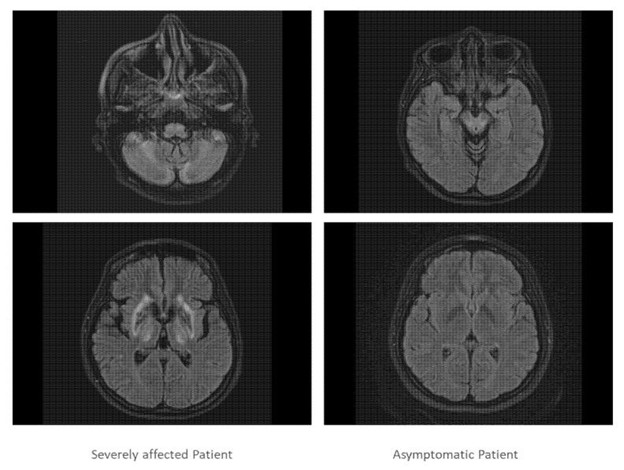
图 3:呈现了严重受影响的双胞胎(左侧)和无症状双胞胎(右侧)的两个头颅 MRI 扫描切片。严重受影响的双胞胎的 MRT 扫描显示皮质、基底节、小脑和脑桥核在疾病过程中严重参与,而无症状患者的 MRI 扫描则正常。 光学相干断层扫描 (OCT) 检查显示,两名患者双眼的视盘大小正常,视网膜神经纤维层 (RNFL) 几乎正常。在分段层中看不到随着 RNFL、GCIP 和 INL 直径减小的威尔逊病变化的具体模式。两名患者的OCT参数存在细微差异,但与正常对照组相比仍处于正常范围内。表 2)。 ;
表 2:姐妹 1 和 2 的不同临床研究
|
调查 |
姐妹 1(严重受影响的双胞胎) |
姐妹 2(无症状双胞胎) |
|
核磁共振成像 |
广泛的损害 |
正常 |
|
华侨城 |
普通的 |
普通的 |
|
ARFI |
2.32 m/s (LFS4: cut-off >= 1.76) |
1.25 m/s (<LFS2: cut-off < 1.27) |
|
基因检测基因型与表型关系的研究课题组 |
许多回声减少的结,中度至重度肝硬化,不排除 HCC |
肝脏轻微肿大,有几个再生结,由于威尔逊病开始肝脏受累 |
|
MELD评分 |
11 |
6 |
cMRI = 颅磁共振成像;OCT = 光学相干断层扫描;ARFI = 声辐射力脉冲弹性成像 ; LFS = Ludwig 纤维化评分 (0–4) ;US = 腹部超声检查;HCC = 肝细胞癌;WD = 威尔逊氏病。
3. 讨论
3.1 以往文献中关于纯合WD双胞胎的报道
已经提出了一些关于具有不同临床表型的纯合威尔逊病双胞胎的病例报告。森佐洛等人。 描述了两个纯合子双胞胎,均因威尔逊病而患有肝硬化,其中一个患有严重的神经精神疾病。两人都接受了肝移植,但随后的结果却截然不同。Członkowska 等人。 检查了两对与威尔逊病表型不一致的同卵双胞胎,并提出表型特征可归因于表观遗传/环境因素。没有提供有关药物的详细信息。凯格利等人。 报道了一例单卵双胞胎出现急性肝功能衰竭需要紧急肝移植,而另一对双胞胎出现轻度肝病。南程等人。 还研究了 5 对威尔逊病双胞胎的临床和遗传特征,并强调了表型不一致的可能性 但没有详细描述表型和治疗的差异(可提供本文的英文翻译)。因此,这些案件不包括在表3.
表3:纯合双胞胎的进一步描述
|
调查 |
严重影响双胞胎 |
受影响较小的双胞胎 |
|
出版物 1:Senzolo 等人。 |
||
|
基因检测 |
两种不同突变的杂合子 (A1183G/R1319X) |
ATP7B 的两种不同突变 (A1183G/R1319X) 的杂合子 |
|
临床表现、体格检查 |
食管静脉曲张出血 锥体外系症状 顽固性腹水 |
腹水 门体性脑病 轻度构音障碍 与药物滥用相关的神经精神疾病 |
|
裂隙灯 |
完整的 KF 环 |
不完全 KF 环 |
|
脑电图 |
双时相θ活动 |
轻度双颞θ活动 |
|
电脑断层扫描 |
基底节低密度 |
无解剖损伤 |
|
肌电图 |
左正中神经感觉和运动改变 |
- |
|
SPECT |
基底 |
双枕叶轻度示踪剂缺损,其他正常 |
|
治疗 |
硫酸锌 (440 mg tid) 依从性差 |
硫酸锌 (440 mg tid) |
|
肝移植 |
2个月后死亡 |
成功的 |
|
Child-Pugh 评分 |
C10 |
C11 |
|
出版物 2:Członkowska 等人。 |
||
|
双对 1 |
|
|
|
基因检测 |
c.3207C>A (p.H1069Q) 和 c.1211_1212insA (p.N404Kfs) 杂合子 |
ATP7B 的 c.3207C>A (p.H1069Q) 和 c.1211_1212insA (p.N404Kfs) 突变杂合子 |
|
临床表现、体格检查 |
轻度黄疸——疲劳 神经精神症状 |
没有肝脏、神经 |
|
裂隙灯(KF 环) |
双侧KF环 |
KF 环为负 |
|
腹部超声检查 |
不均匀回声增强的区域 |
普通的 |
|
肝活检 |
伴有炎症浸润的瘢痕和再生结节 肝硬化 |
呐 |
|
核磁共振 |
|
普通的 |
|
双对 2 |
|
|
|
基因检测 |
纯合错义突变 c.3207C>A (p.H1069Q) |
ATP7B 的纯合错义突变 c.3207C>A (p.H1069Q) |
|
临床表现、体格检查 |
轻度构音障碍 左上臂轻度麻痹 轻度共济失调,步态宽阔 |
没有肝脏、神经 |
|
裂隙灯(KF 环) |
双侧KF环 |
双侧 KF 环饱和度较低 |
|
腹部超声检查 |
左叶肝脾肿大,多处高回声病灶 |
肝脾肿大门静脉扩张(11.9 毫米) |
|
核磁共振成像 |
BG、丘脑、中脑、脑桥和脑脚的 T2 加权图像信号增加,小脑明显萎缩和脑干萎缩特征 |
豆状神经节、丘脑、脑脚和脑桥的 T2 加权图像信号增加 |
|
出版物 3:Kegley 等人。 |
||
|
基因检测 |
ATP7B的纯合突变(H1069Q) |
ATP7B的纯合突变(H1069Q) |
|
临床表现、体格检查 |
全身不适 疲劳 腹痛 |
没有迹象和症状 |
|
肝活检 |
微结节性肝硬化伴有显着的小管增生、胆汁淤积、轻度脂肪变性和持续的肝细胞坏死 定量铜:2241 lg/g 移植肝干重) |
1 至 2 级纤维化 |
|
治疗 |
拒绝任何药物 |
首先拒绝任何药物,然后是铜螯合剂 |
|
肝移植 |
成功的原位肝移植 |
呐 |
治疗细节突出显示在表3.
3.2 症状发作时缺乏表型/基因型相关性
WD 的临床症状是由铜中毒引起的组织损伤引起的。铜中毒取决于接触的持续时间和渗入器官组织的有毒铜的量。然而,WD 中器官的损伤不仅取决于铜向器官的运输,还取决于器官的再生能力。例如,肝脏在威尔逊病中早在其他器官参与之前就已暴露于大量铜,但它具有很高的再生能力。另一方面,中枢神经系统长期受到血脑屏障的保护,不受铜的影响。然而,它很容易受到重金属中毒的影响 。
诊断时间的差异以及营养和生活方式的差异都增加了表型的变异性。超过 1000 种不同的 ATP7B 基因突变导致高基因型变异 。因此,WD 中没有明确的基因/表型相关性也就不足为奇了。
在基因检测基因型与表型关系的研究课题组的威尔逊病双胞胎中,直到他们结婚之前,他们的疾病发展没有明显差异。婚后,两姐妹生活在不同的地方,而姐妹 2 在婚后不久就怀孕了,这(至少理论上)可能是对开始威尔逊病的一种不同寻常的处理。因此,基因检测基因型与表型关系的研究课题组认为生活方式和怀孕的差异可能导致威尔逊病临床表现的差异。从升高的肝酶水平可以看出威尔逊病也可能在姐妹 2 中表现出来,即使开始威尔逊病特异性治疗,肝酶水平也会进一步恶化(图 2B,左侧)。
3.2 治疗开始后缺乏表型/基因型相关性
当开始威尔逊病特异性治疗时,情况变得更加复杂。患者接受不同的药物和不同剂量的特定药物治疗。WD 中的某些症状对治疗的反应比其他症状更好 。因此,仔细监测治疗效果很重要。
为了改善神经系统症状,可能需要比改善肝脏症状更高剂量的 DPA。基因检测基因型与表型关系的研究课题组观察到中枢神经系统的葡萄糖代谢继发性恶化取决于使用少于 1000 毫克 DPA 的治疗持续时间 。因此,基因检测基因型与表型关系的研究课题组建议在具有中度至重度神经系统表现的威尔逊病患者中使用至少 1200 mg DPA 的剂量 。这是 Sapuppo 等人观察到的具有相同基因型的两个姐妹对 1000 毫克/天的不同反应的可能解释。。在这种治疗下,患有神经系统症状的姐妹进一步恶化,而另一位有肝脏表现的姐妹则有所改善。
姐妹 1 接受的 DPA 剂量远高于姐妹 2。原则上,高剂量的 DPA 会导致神经系统症状进一步恶化。然而,基因检测基因型与表型关系的研究课题组认为这不会发生在姐姐 1 身上,因为她在肾病综合征发展之前就开始好转。无论如何,对药物反应的差异会进一步导致威尔逊病的长期结果不同。
不幸的是,仅报道了少数表型不一致的纯合威尔逊病双胞胎的治疗细节(见表3)。这使得解释具有相同基因型但表型不同的威尔逊病双胞胎的不同病程几乎是不可能的。
3.3 表观遗传因素的可能影响
表观遗传机制的潜在作用已被强调 并在威尔逊病动物模型中进行了探索 。在威尔逊病大鼠中,高热量饮食会加重线粒体功能障碍并引发严重的肝损伤 。
在基因表达调控和环境之间的界面是蛋氨酸代谢,这是一种对 DNA 甲基化具有调节作用的代谢途径。S-腺苷同型半胱氨酸 (SAH) 水解酶 (SAHH;也称为 AHCY) 在蛋氨酸代谢中起着至关重要的作用,因为它负责将 SAH 代谢为同型半胱氨酸。如果 SAHH 的表达或活性降低,作为 DNA 甲基化反应抑制剂的 SAH 水平将增加。重要的是,在肝脏铜积累的情况下,SAHH 酶活性和基因 (AHCY) 转录水平会降低,从而导致下游蛋氨酸代谢参数发生变化。
值得注意的是,来自杰克逊实验室的有毒牛奶小鼠(tx-j 小鼠)具有影响铜转运蛋白第二跨膜区域的自发点突变,表现出蛋氨酸代谢失调和肝细胞中的整体 DNA 低甲基化 ,可能对参与肝损伤发展的基因的调节产生下游影响。此外,在胚胎发育过程中,与对照动物相比,肝脏(主要甲基化重排位点)在 tx-j 小鼠中与细胞周期和复制相关的基因转录水平发生了重大变化 。向怀孕小鼠提供补充甲基供体胆碱能够使胚胎小鼠中的基因表达达到与对照动物相同的水平,这表明胎儿肝脏易受营养因素的影响,并可能对疾病表型和进展造成终生影响 。
3.4. 修饰基因的可能影响
到目前为止,WD 被认为是一种单基因疾病。然而,不能排除修饰基因的额外参与,只要尚未在更大的威尔逊病患者队列中进行全基因组分析。在最近对一大群长期治疗的威尔逊病患者的临床发现进行的分析中,已经描述了广泛的合并症,并可能与威尔逊病相互作用 。这在图形方案中进行了总结。
4. 威尔逊病基因型与表型关系的研究结论
在威尔逊病特异性治疗之前或之后,WD 中没有明确的基因/表型相关性。观察到纯合威尔逊病双胞胎可能表现出完全不一致的表型和对治疗的完全不同的反应行为,如上述病例,这一点得到了支持。原因知之甚少,从生活方式和依从性的差异到对基因调控的复杂代谢影响不等。
Review:Genes (Basel), 2022 Jul 7;13(7):1217. doi: 10.3390/genes13071217.
Different Response Behavior to Therapeutic Approaches in Homozygotic Wilson's Disease Twins with Clinical Phenotypic Variability: Case Report and Literature Review
(责任编辑:admin)



