【佳学基因检测】单纯性大疱性表皮松解症基因检测Epidermolysis bullosa simplex
遗传病、罕见病基因检测导读:
大疱性表皮松解症 (EB)基因检测是对一种罕见的遗传病所进行的基因测序分析,并对发现的基因突变进行致病性确定。大疱性表皮松解症临床表现差异很大,难以建立起基因型和表型之间的清晰的关系。佳学基因检测通过不断为不同的患者进行检测,从而确立基因型与表型之间的关系。在本案例中,一个中国家庭中的两名成员被诊断出患有局限性单纯性 EB(EBS),其临床表现包括从婴儿期起脚底出现水疱和糜烂。案例中采用的基因检测包括两名患者、其他健康家庭成员和 100 名正常对照。从每个参与者身上分离出基因组 DNA 样本,然后进行聚合酶链反应 (PCR) 直接测序。PCR 直接测序基因检测结果显示, KRT5外显子 7 的密码子 461 发生了新的杂合错义突变(c.1382T>C),导致 单纯性大疱性表皮松解症(EBS) 患者发生氨基酸变化(p.L461P),但未受影响的患者和100 个无关的对照样本则不存在该突变
单纯性大疱性表皮松解症基因检测关键词:
单纯性大疱性表皮松解症,角蛋白 5,突变
单纯性大疱性表皮松解症基因检测介绍
根据《皮肤病的临床图谱及其基因检测项目推荐》,大疱性表皮松解症 (EB) 包括一组遗传性疾病,其中水泡自发出现或在轻微损伤或摩擦后出现。大疱性表皮松解症 (EB) 的表型谱变化很大,不同类型大疱性表皮松解症 (EB) 的严重程度和相关的外来表现存在差异。然而,所有类型的大疱性表皮松解症 (EB) 都存在外伤性水泡和脆性。根据相对于基底膜的真皮-表皮分离程度,大疱性表皮松解症 (EB) 可分为四种亚型——单纯型、交界型、营养不良型和金德勒综合征. 在最常见的亚型大疱性表皮松解症 (EB) 单纯性 (EBS) 中,分离发生在表皮角质形成细胞基底层或基底层之上。1986年至2002年的统计显示,大疱性表皮松解症 (EB)的患病率约为每100万居民11例,发病率约为每100万活产19例。单纯性大疱性表皮松解症(EBS) 显示出显着的遗传和临床异质性。单纯性大疱性表皮松解症(EBS) 可细分为全身重症 (Dowling-Meara)、全身中度 (Koebner) 和局部亚型. 局限性 单纯性大疱性表皮松解症(EBS) (OMIM 131800) 是最温和的亚型,其中大疱性病变通常发生在出生或婴儿期,但也可能出现在青春期或成年早期。临床上,水泡和大疱主要局限于手掌和足底区域,没有指甲和粘膜损伤。
几乎所有 单纯性大疱性表皮松解症(EBS) 突变都遵循常染色体显性遗传模式。单纯性大疱性表皮松解症(EBS) 主要与两个基因KRT5和KRT14的突变有关。KRT5和KRT14基因分别编码基底表皮角蛋白 5 和 14。角蛋白 5 和角蛋白 14 都具有中央杆状 α 螺旋结构和两侧的非螺旋结构(头部和尾部)。在中心棒状区域的开始和末端,有两个高度保守的氨基酸序列,称为螺旋起始肽(HIP)和螺旋终止肽(HTP). 在大多数情况下,突变的位置决定了临床表型的严重程度。例如,影响角蛋白丝组装的 HIP 和 HTP 突变导致最严重的 Dowling-Meara 单纯性大疱性表皮松解症(EBS)(EBS-DM;OMIM 131760);突变通常会导致非螺旋接头区域的局部 单纯性大疱性表皮松解症(EBS),而 Koebner(EBS-K;OMIM 131900)突变更广泛地分布在角蛋白 5 和角蛋白 14 多肽上。迄今为止,佳学基因已经记录了超过 150 种与这些基因相关的不同致病突变,其中大多数与更严重的 EBS-DM 相关。
在单纯性大疱性表皮松解症基因检测中,对来自中国家庭的两名被诊断为局限性单纯性大疱性表皮松解症(EBS) 的患者进行了基因检测分析,发现位于 KRT5 2B 区段的新型错义突变 c.1382T>C (p.L461P) 证实了局限性单纯性大疱性表皮松解症(EBS) 的诊断。新突变和基因型-表型关联的鉴定有助于更好地了解局部单纯性大疱性表皮松解症(EBS) 的潜在病理生理学基础,对于疾病进程预测、基因诊断、遗传咨询和基因治疗非常重要。
研究性单纯性大疱性表皮松解症基因检测是如何进行的?
临床评估和 DNA 取样
总共有五个局限性单纯性大疱性表皮松解症(EBS) 患者是这次单纯性大疱性表皮松解症基因检测研究的对象(图1) 参加了这项研究。成员 II:1(42 岁女性)和 III:1(15 岁女性;先证者)到佳学基因合作医院就诊。佳学基因检测的分析还包括先证者的父亲、祖父母和 100 名正常对照受试者。从所有参与的个人(或其监护人)获得书面知情同意书,并从每个参与者抽取 5 毫升抗凝静脉血用于 DNA 提取。所有参与者的临床检查均由皮肤科医生进行。研究的程序和过程遵照赫尔辛基宣言的原则进行的,得到了医院机构审查委员会的授权。我们收到了患者关于发布所有摄影材料的同意书。铜陵市人民医院伦理委员会 (2020001) 获得伦理批准。
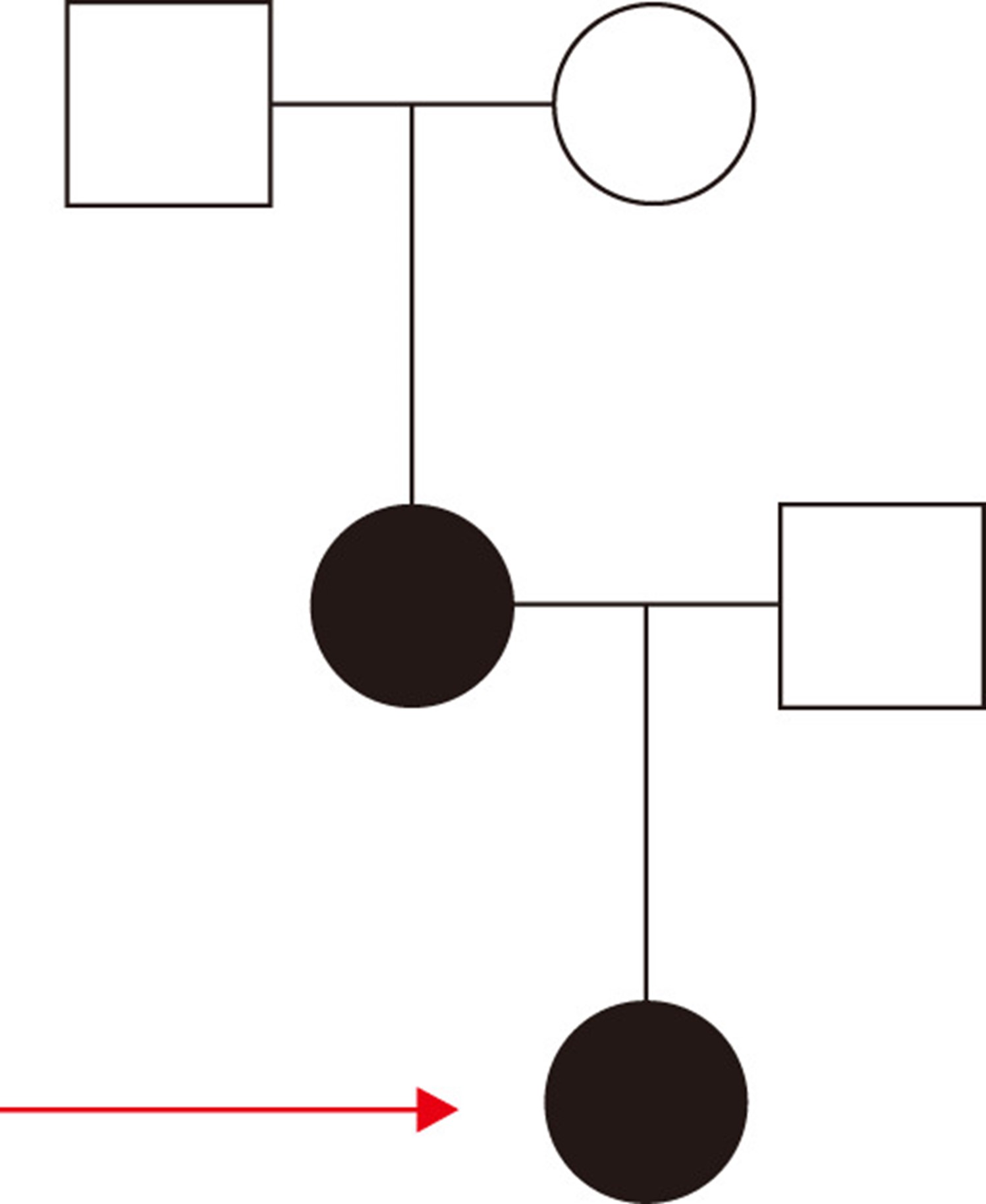
图1:家族血统。家谱显示了三个世代中的两个受影响的成员。未填充的符号代表谱系中未受影响的成员;深色符号表示受影响的成员。圆圈和正方形分别代表女性和男性。系谱的先证者已用红色箭头标记。
突变分析和多序列比对
我们使用聚合酶链式反应 (PCR) 来扩增基因组 DNA 样本(Humphries 等人,1996 年),之后用 Sanger 测序对 PCR 产物进行测序。咨询国家生物技术信息中心 (NCBI) cDNA 参考序列NM_000424.3用于KRT5和NM_000526.4用于KRT14,我们确定了仅存在于受临床影响的家庭成员中的特定突变。多个在线生物信息学软件程序,包括以下 PolyPhen2 ( http://genetics.bwh.harvard.edu/pph2 )、SIFT ( http://sift.bii.a-star.edu.sg ) 和 Mutation Taster ( http://genetics.bwh.harvard.edu/pph2 ) ://www.mutationtaster.org/), 用于预测由此产生的氨基酸取代是否会对 KRT5 和 KRT14 的结构和功能产生影响。我们比对了不同物种的蛋白质,包括Bos taurus、Gallus gallus、Gorilla gorilla、Mus musculus和Oryctolagus cuniculus。野生型和突变型 (p.L461P) 之间的结构变化由 SWISS-MODEL ( https://swissmodel.expasy.org , PBD: 3TNU) 预测。野生型和突变型的结构比较揭示了它们之间的显着差异。
结果
受影响患者的表型特征
这个家庭有两个受影响的人。先证者是一名 15 岁的中国女孩,是无血缘关系的中国父母的独生女。她和她妈妈有相似的临床症状,没有其他家族史。自出生以来,先证者和她的母亲在足部受到机械损伤后容易出现水泡,但水泡愈合后不留疤痕。症状在夏季更严重,并随着年龄的增长而改善。身体检查除水泡外均正常(图 2). 先证者右足底水疱病理检查示表皮角化过度,颗粒层和棘层增厚,表皮内形成水泡。真皮乳头层血管轻度扩张,炎性细胞浸润少,血管周围间质轻度黏液性(图 2)本病的诊断是结合典型的临床表现、家族史和病理检查,故诊断为局限性单纯性大疱性表皮松解症(EBS)。我们进行的分子测试进一步证实了诊断。
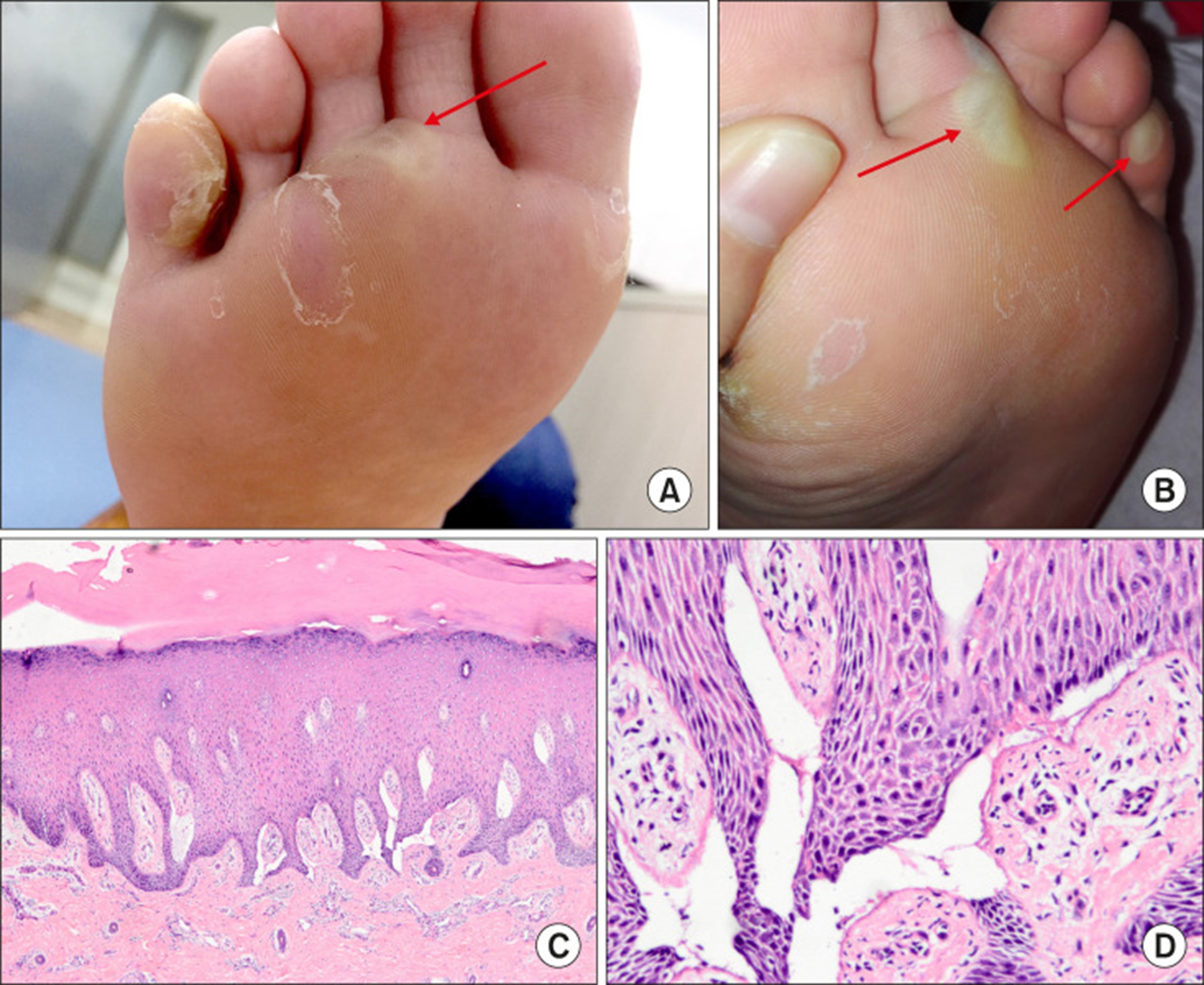
图 2: 局限性单纯性大疱性表皮松解症患者的临床表现。图中的水泡已用红色箭头标记。(A) 在先证者的右脚上观察到水泡和糜烂。(B) 在母亲的左脚底发现了类似的水泡。(C)表皮上皮过度角化,棘层增厚,表皮内有小泡(H&E, ×40)。(D) 裂隙位于表皮内 (H&E, ×200)。
突变分析和蛋白质结构建模
局限性 单纯性大疱性表皮松解症(EBS) 是 单纯性大疱性表皮松解症(EBS) 最常见的临床变异性疾病之一,也是最轻的一种。根据已发表的数据,许多基因的突变与 单纯性大疱性表皮松解症(EBS) 表型相关,包括TGM5、PLEC、PKP1、KRT5、KRT14、DSP、JUP、DST和EXPH5,但超过 75% 的 单纯性大疱性表皮松解症(EBS) 病例归因于 KRT5 的突变或KRT14基因12。因此,我们在这里选择这两个基因作为候选致病基因来筛选突变。
先证者 DNA 的分子分析表明,在KRT5基因外显子 7 的核苷酸位置 1382 (c.1382T>C) 存在杂合的 T 到 C 转变。该突变导致密码子 461 (p. Leu461Pro) 的脯氨酸残基被亮氨酸取代。在先证者的母亲中检测到KRT5中的相同突变。该突变位于KRT5的 2B 区段,证实了局部 单纯性大疱性表皮松解症(EBS) 的诊断。在KRT5或KRT14中未发现其他突变。在未受影响的家庭成员或 100 名人口匹配的健康对照中未发现突变(图 3). PolyPhen2 ( http://genetics.bwh.harvard.edu/pph2 )、SIFT ( http://sift.bii.a-star.edu.sg ) 和 Mutation Taster ( http://www.mutationtaster.org/ ) 都预测突变 c.1382T>C (p.L461P) 可能会破坏蛋白质功能,尽管脯氨酸和亮氨酸具有相似的极性。
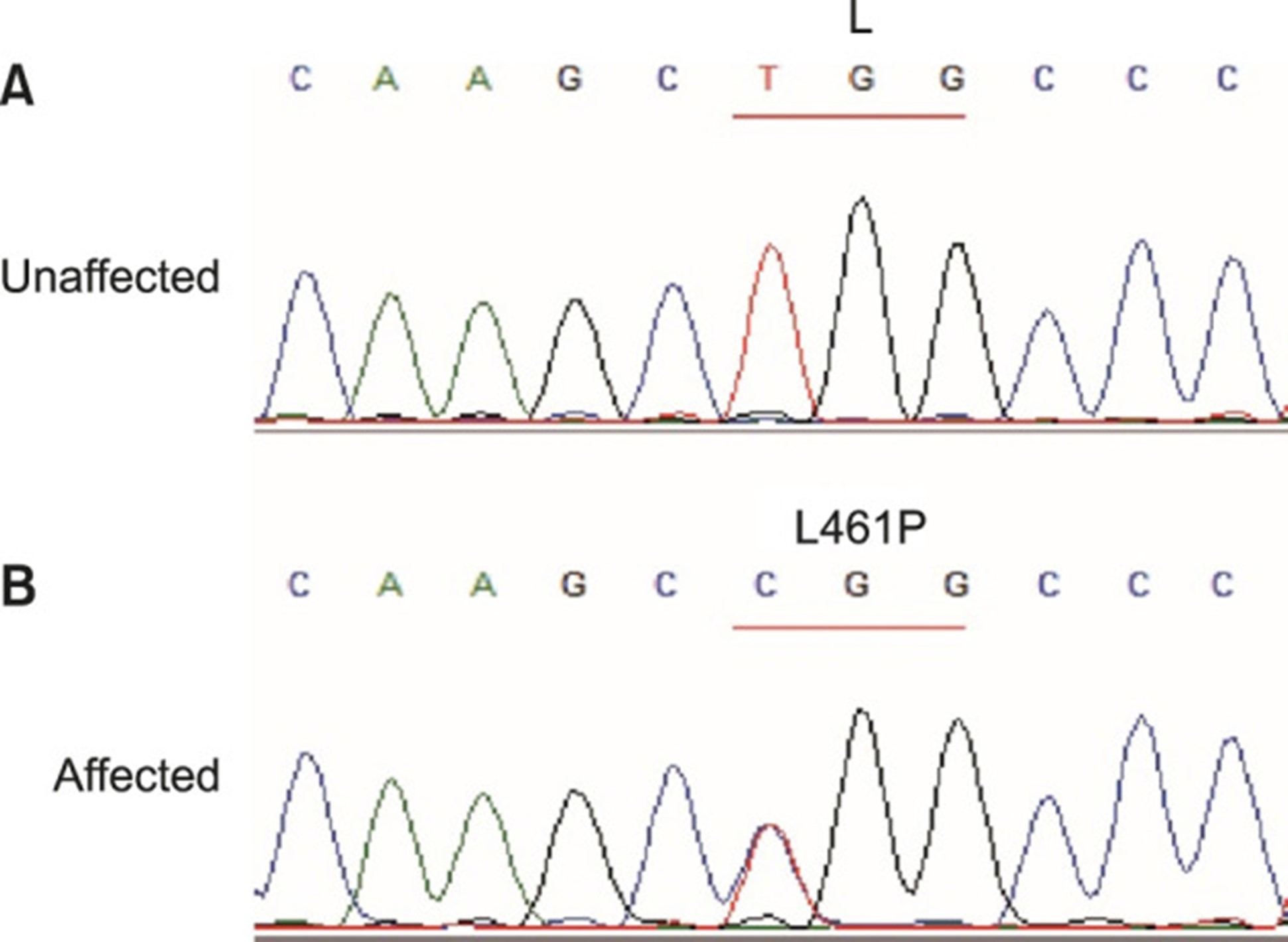
图 3:KRT5突变分析。分子分析表明KRT5基因中存在从头杂合错义突变 c.1382T>C (p.Leu461Pro) 。(A) 未受影响的成员,(B) 受影响的成员。
我们比较了来自不同物种的蛋白质,并获得了来自不同物种的 KRT5 的基于结构的多序列比对,表明突变 (p. l 461pro) 位于高度保守的区域 (图 4).

图 4:来自不同物种的 KRT5 的多序列比对。来自不同物种的 KRT5 基于结构的多序列比对显示突变 (p.Leu461Pro) 位于高度保守的区域内。
在野生型 KRT5 中,Leu461 与 Met457 和 Val465 形成两个氢键,而突变体 Pro461 仅与 Val465 形成一个氢键。氢键的减少可能会影响 2B α 螺旋结构域的稳定性,其空间结构由氢键维持(图 5). c.1382T>C(p.L461P)突变发生在非螺旋连接区,同极性的脯氨酸取代了亮氨酸,导致存在最轻的单纯性大疱性表皮松解症(EBS)。总的来说,这些结果表明KRT5中的 p.L461P 是该家族中局部 单纯性大疱性表皮松解症(EBS) 的致病突变。
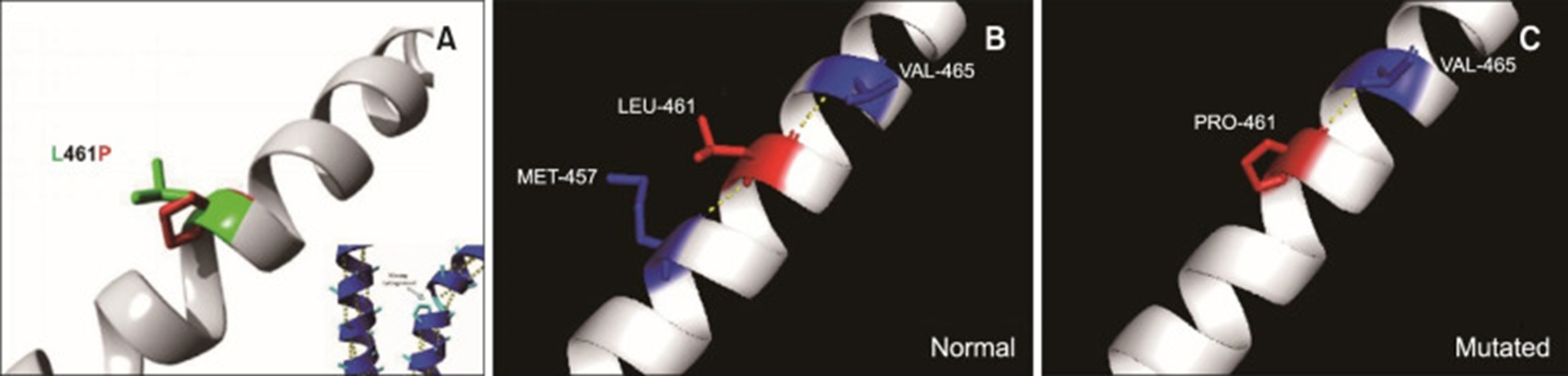
图 5:L461P 突变的结构模型。黄色虚线表示两个氨基酸之间的氢键并显示结构之间的差异。(A) LEU-461 和 PRO-461 分别为绿色和红色。(B) 在野生型 KRT5 中,LEU-461 形成两个氢键(与 MET-457 和 VAL-465)。(C) 突变体 PRO-461 仅形成一个氢键(与 VAL-465)。
检索报告的 KRT5 突变和分析
为了研究 KRT5 突变是否存在任何富含突变的外显子,我们检索了 KRT5 中所有报告的突变。如图所示表格1,自 2008 年 1 月 1 日以来,已发现约 28 个导致 单纯性大疱性表皮松解症(EBS) 的新型 KRT5 突变。KRT5 尾部结构域的突变通常与 单纯性大疱性表皮松解症(EBS) 游走性环状红斑 (EBS-Migr) 和疾病的色素形式相关,表明该区域可能在调节色素沉着和炎症方面发挥作用。另外,在基因诊断方面,筛查引起单纯性大疱性表皮松解症(EBS)的突变时,更应注意这些编码尾区的外显子。我们注意到只有少数突变与局部 单纯性大疱性表皮松解症(EBS) 相关,这些突变分布在 KRT5 的所有区域,但主要聚集在头部和非螺旋接头区域。示例包括 p.Val133Met、p.Asn146Lys、p.Met327Thr、p.Asp328Gly 和我们研究中的新突变 ( p.Leu 461Pro) 。它表明,如果患者被诊断为局限性 单纯性大疱性表皮松解症(EBS),则编码 KRT5 头部和非螺旋接头区域的序列应该适合突变筛查。由于基因表达过程复杂,易受其他基因和外界因素的影响,因此在预测基因型与表型之间的关系时需谨慎。
表格1:局限性大疱性表皮松解症的新型KRT5突变
|
作者(年) |
外显子 |
核苷酸变化 |
蛋白质变化 |
角蛋白结构域 |
|---|---|---|---|---|
|
Jerábková 等人(2010) |
1个 |
c.428T>C |
p.V143A |
头 |
|
Wertheim-Tysarowska 等人(2016) |
1个 |
c.436A>T |
p.N146Y |
头 |
|
金等人(2017) |
1个 |
c.464T>C |
p.L155P |
头 |
|
金等人(2017) |
1个 |
c.502G>C |
p.E168Q |
头 |
|
皆川等(2013) |
1个 |
c.505C>G |
p.R169G |
1A |
|
阿林等人(2010) |
1个 |
c.514A>G |
p.I172V |
1A,髋关节 |
|
金等人(2017) |
1个 |
c.535T>C |
p.F179L |
1A |
|
Glasz-Bóna 等人(2009) |
1个 |
c.547A>G |
p.I183V |
1A |
|
加西亚等人(2011) |
1个 |
c.557T>A |
p.V186E |
1A |
|
Glasz-Bóna 等人(2009) |
1个 |
c.570G>C |
p.E190D |
1A |
|
鲍登等(2009) |
1个 |
c.593C>G |
p.T198S |
1A |
|
弗洛希尔等(2010) |
1个 |
c.596A>T |
p.K199T |
1A |
|
高等(2015) |
1个 |
c.605T>C |
p.L202Q |
1A |
|
赵等人(2014) |
1个 |
c.608T>C |
p.L203P |
L1 |
|
加西亚等人(2011) |
3个 |
c.961A>C |
p.T321P |
L12 |
|
蒋等人(2008) |
3个 |
c.971T>C |
p.V324A |
L12 |
|
Wertheim-Tysarowska 等人(2016) |
3个 |
c.974T>C |
p.L325P |
L12 |
|
阿林等人(2010) |
3个 |
c.991C>A |
p.R331S |
L12 |
|
Glasz-Bóna 等人(2009) |
3个 |
c.991C>G |
p.R331G |
L12 |
|
Lev-Tov 等人(2012) |
6个 |
c.1270G>C |
p.A424P |
2B |
|
加西亚等人(2011) |
6个 |
c.1283G>A |
p.A428T |
2B |
|
皆川等(2013) |
6个 |
c.1327A>G |
p.K443E |
2B |
|
阿林等人(2010) |
6个 |
c.1362del4insAGCTGGTA |
p.E455AfsX117 |
2B |
|
Wertheim-Tysarowska 等人(2016) |
7 |
c.1412G>A |
p.R471H |
2B |
|
阿林等人(2010) |
7 |
c.1438A>G |
p.R480G |
2B、HTP |
|
阿林等人(2010) |
8个 |
c.1636C>A |
p.L546I |
尾巴 |
|
皆川等(2013) |
9 |
c.1644del4 |
p.G550A |
尾巴 |
|
Bchetnia 等人(2012) |
9 |
c.1675C>T |
fsX82 p.R559X |
尾巴 |
HIP:螺旋起始肽,HTP:螺旋终止肽。
单纯性大疱性表皮松解症基因检测讨论
KRT5和KRT14基因编码表皮基底层和相关复合上皮细胞中的中间丝 (IF) 蛋白。角蛋白中间丝 (KIF) 网络附着于桥粒和半桥粒,将角质形成细胞连接到相邻细胞和基底膜,形成细胞间粘附,保护上皮细胞免受机械和其他应力。单纯性大疱性表皮松解症(EBS) 与KRT5和KRT14的突变密切相关,但突变导致角蛋白网络形成和崩溃的机制仍不清楚。
据报道,KRT5/KRT14细丝网络结构的破坏会导致基底角质形成细胞的脆弱性,使细胞无法承受机械压力,进而导致细胞内出现空泡,最终导致皮肤起泡。萨万特等人。发现苏氨酸 150 (T150) KRT5 磷酸化在 KIF 网络的形成中起重要作用,与 单纯性大疱性表皮松解症(EBS) 的发病机制有关。此外,其他病理机制在单纯性大疱性表皮松解症(EBS)的病理生理学中起着重要作用,包括炎症前细胞因子、肿瘤坏死因子、白细胞介素-1β(IL-1β)以及与之相关的信号通路。罗素等人。发现由于机械应力导致ERK和PKB的细胞外信号调节激酶(ERK)和蛋白激酶B(PKB)信号转导通道的激活参与了单纯性大疱性表皮松解症(EBS),导致角蛋白突变细胞在通道激活后对细胞凋亡产生抗性 . 除此之外,疾病的发生还涉及其他机制,包括机械应力恢复受损、细胞连接元件下调和上皮细胞粘附破坏。到目前为止,我们不知道该突变 (p.L461P) 如何导致该家族的临床表现;需要进一步的研究来深入了解本研究中发现的突变的详细分子发病机制。
目前,单纯性大疱性表皮松解症(EBS)尚无有效的治疗方法;主要治疗是对症处理。例如足底注射肉毒毒素,作为一种安全且持久的方法,可以有效阻止水泡的发生。此外,据报道长期口服红霉素可能对EBS-DM有效 。1% 双醋瑞因软膏被认为是一种耐受性良好且安全的靶向治疗,可显着减少大多数 EBS-DM 患者的水疱。由于在 EBS-DM 患者的水疱顶部和皮肤液体中发现 Th17 细胞因子过度表达,在使用抗 IL-17 药物治疗后,观察到所有患者的水疱数量急剧减少. 西兰花产生的天然化学物质萝卜硫素已被证明可以通过诱导表皮基底层中 KRT16 和 KRT17 的表达并改善 单纯性大疱性表皮松解症(EBS) 表型来治疗 KRT14 缺陷小鼠的水疱。最近,北京等人。成功开发了一种体外基因疗法,使用成簇规律间隔的短回文重复序列 (CRISPR)/Cas9 来纠正复发性COL7A1异种移植小鼠模型中营养不良性 大疱性表皮松解症 (EB) 的突变。显然,在用 RNA 治疗 大疱性表皮松解症 (EB) 方面取得了相当大的进展,但也存在局限性。由于它是一种遗传疾病,基因组编辑作为最先进的基因治疗方法可以用于临床治疗。具体而言,由于KRT5基因中的突变为 c.1382T>C,因此可以使用胞苷碱基编辑器对其进行校正,从而实现 C 到 T 的转换。
总之,这是一项报告 KRT5 的研究:2B 螺旋处的 p.L461P 错义突变,或 KRT5 密码子 461 中的任何突变。鉴定 KRT5 中的这种新突变 (p.L461P) 将有助于更好地了解局部 单纯性大疱性表皮松解症(EBS) 的潜在病理生理学基础,可用于基因诊断、遗传咨询和基因治疗。此外,它还可以更深入地了解 单纯性大疱性表皮松解症(EBS) 中的表型-基因型相关性。
(责任编辑:admin)



