【佳学基因检测】黑色素瘤CDK4/6靶向药物
肿瘤靶向药物基因检测导读:
从历史上看,转移性黑色素瘤被认为是一种高度致命的疾病。然而,药物开发的最新进展使预后有了显着改善。特别是,BRAF/MEK 抑制剂和抗 PD1 抗体彻底改变了这种疾病的管理。尽管如此,并非所有患者都能从这些疗法中获益或持久获益。为了克服这一挑战,新的临床活性化合物正在临床试验中进行测试。CDK4/6 抑制剂是已经在临床实践中可用的药物,初步证据显示在黑色素瘤中也有很好的活性。在这里,肿瘤靶向药物基因检测的应用研究组回顾了现有的文献,以描述关于黑色素瘤中 CDK4/6 抑制剂的全面情况。肿瘤靶向药物基因检测的应用研究组提出了可能证明使用这些药物的分子和遗传背景,
肿瘤靶向药物关键词
CDK4/6、CDK4、CDK6、黑色素瘤、帕博西尼、瑞博西尼、玻玛西尼
1、黑色素瘤及其靶向药物基因检测
从历史上看,转移性黑色素瘤被认为是一种高度致命的疾病。然而,药物开发的最新进展已显着改善黑色素瘤患者的预后。特别是,BRAF/MEK 抑制剂和抗 PD1 抗体彻底改变了这种疾病的治疗。尽管它们具有相关的功效,但仍然存在一些未满足的临床需求。例如,近40 %的抗PD1治疗的反应率仍不能令人满意;另一方面,由于耐药性的发展,BRAF/MEK 抑制剂通常无法在很长一段时间内控制疾病。为了克服这一挑战,非常需要新的临床活性化合物。
CDK4 通路是黑色素瘤中经常改变的信号通路。考虑到 CDK4/6 抑制剂目前的临床可用性,对黑色素瘤中 CDK4/6 抑制的兴趣日益增加。事实上,一些临床试验正在测试这些化合物的功效,特别是作为多药方案的一部分。
在这里,肿瘤靶向药物基因检测的应用研究组回顾了现有的文献,以描述关于黑色素瘤中 CDK4/6 抑制剂的全面情况。肿瘤靶向药物基因检测的应用研究组介绍了可能证明使用这些药物的分子和遗传背景、临床前证据、临床可用数据以及最有希望的正在进行的临床试验。
2、CDK4/6 通路
细胞分裂周期 (CDC) 是促有丝分裂和促凋亡/阻滞信号之间动态平衡的结果,它们在调节网络中相互作用。
通过 CDC 阶段的细胞进展需要克服关键点,例如限制点 (R)、G1-S 转换的看门人和细胞检查点。这些转变主要由不同的异二聚体复合物的顺序激活驱动,每个复合物由细胞周期蛋白和细胞周期蛋白依赖性激酶 (CDK) 的结合构成,分别具有调节和催化功能。
每个 CDC 阶段都由 cyclin/CDK 复合物特异性调节,从 G1 期到 S 期的进展是由 cyclin-D-CDK4/6 相互作用触发的。见图1。
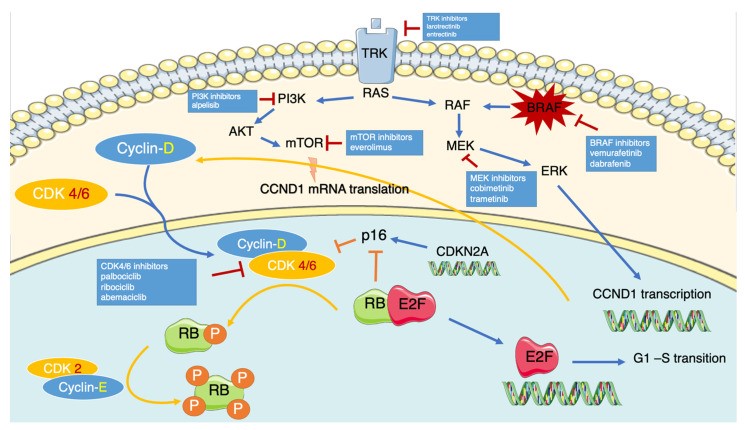
图1:调节 p16ink4A-cyclin D-CDK4/6-RB 通路的最相关通路及其相互关系
调节 p16ink4A-cyclin D-CDK4/6-RB 通路的最相关通路及其相互关系的图示。有丝分裂原刺激细胞膜上的酪氨酸激酶受体激活 Ras 轴,导致 CCND1 基因的转录,同时 Cyclin-D 的表达增加。同时,PI3K 通路 (PI3K-Akt-mTor) 通过 mTor 调节 CCND1 mRNA 的下游翻译。在细胞胞质溶胶中,Cyclin D1 与其结合伙伴 CDK4/6 形成复合物,并转运至细胞核。在这里,它与下游复合物 CyclinE-CDK2 相互作用,使 RB 蛋白过度磷酸化,从而使其失活。随后,E2F 被释放并驱动参与 G1-S 转换的基因的转录。该途径受到一些天然抑制剂的负调控,例如 p16INK4A,可抑制 Cyclin D-CDK4/6 复合物的组装。此外,p16INK4A 通常被 RB 的低磷酸化形式抑制。CDK4/6 介导的 RB 过度磷酸化导致其失活并减轻 RB1 介导的 p16INK4A 抑制。
由 CCDN1 基因编码的 Cyclin D 蛋白参与多种细胞内途径,包括依赖和不依赖 CDK4/6 的途径,例如促进细胞增殖和调节线粒体活性、DNA 损伤修复和细胞迁移。
在疾病预防控制中心期间,细胞周期蛋白 D 的水平和亚细胞分布随振荡行为而变化,以响应增殖和有丝分裂刺激;在生长因子与其酪氨酸激酶受体(例如,IGFR、c-kit、FGFR)结合后,激活的 RAS/RAF/MEK/ERK 级联诱导 CCDN1 的转录,从而增加 G1 早期的 cyclin D 表达阶段。在 cyclin D 与 CDK4/6 异二聚化后,活化的复合物移至细胞核,并与 cyclin-E/CDK2 协同作用,诱导三种蛋白质的过度磷酸化和随之而来的损害,均具有生长抑制特性:肿瘤抑制因子视网膜母细胞瘤蛋白 (RB)、视网膜母细胞瘤样蛋白 1 (p107) 和视网膜母细胞瘤样蛋白 2 (p130)。结果,E2F转录因子从RB上解离并发挥其活性,启动DNA复制所需基因的转录,促进细胞周期进入S期。
为了避免异常的细胞增殖,该过程受到 INK4(包括 p16 ink4A、p15 ink4B、p18 ink4C、p19 ink4D)、Cip 和 Kip(p21 CIP1和 p27 KIP1)家族蛋白的抑制。INK4 蛋白与 CDK4/6 单位特异性结合并阻止细胞周期蛋白-D-CDK4/6 复合物的组装,而 p21 CIP1和 p27 KIP1与细胞周期蛋白和 CDKs 单位相互作用,使它们稳定。由于这种抑制,细胞在 G1-S 过渡阶段停止。
由 p16 ink4A和 RB之间的相互作用促进的负反馈回路提供了额外的抑制控制。在生理上,p16 ink4A被活化(低磷酸化)形式的 RB 抑制;因此,由 CDK4/6 介导的 RB 过度磷酸化可减轻 p16 ink4A的抑制。
除了依赖 RB 的机制(定义为经典途径)外,复杂的 cyclin-D-CDK4/6 通过调节分别参与衰老、凋亡和凋亡的 FOXM1、MYC 和 SMAD3 表达直接调节细胞周期进程G1-S 过渡。
3、黑色素瘤中的 CDK4/6 通路失调
p16 ink4A -cyclin D-CDK4/6-RB 通路的失调在许多癌症类型中很常见,并且在高达 90% 的黑色素瘤中被识别,并且在该轴的许多节点中发生改变。
这些变化包括 CDKN2A 的丢失或失活(编码 p16)、CCND1 的异常或过表达,以及 CDK4/6 的突变或扩增。这些异常是抑制控制系统下调或促有丝分裂信号通路过度激活的原因。
CDKN2A 改变,包括缺失、突变或启动子甲基化,导致 p16 表达丧失,对 CDK4/6 介导的细胞增殖缺乏控制。与良性痣相比,在黑色素瘤组织中观察到这些修饰的发生率更高 [ 21 ],表明它们在黑色素瘤发生中的关键作用。此外,生殖系 CDKN2A 突变已被证明会增加患黑色素瘤的易感性。
精氨酸残基 24 (CDK4 R24C ) 中的 CDK4 突变目前在具有家族倾向的黑色素瘤患者中被报道,并阻止 p16 与催化亚基结合,触发激酶的组成型激活,并赋予类似于 p16 丢失的生物学行为,如临床前模型所证明的。
CCND1 在 p16 ink4A -cyclin D-CDK4/6-RB 通路的致癌进化中起关键作用,CCND1 是许多上游刺激汇聚的节点。
CCND1 扩增的流行存在争议并且频率因黑色素瘤类型而异,肢端黑色素瘤的检出率较高。基因拷贝数和扩增水平通常与细胞周期蛋白 D 的表达相关,但相反,细胞周期蛋白 D 的过度表达并不一定跟随基因表达的改变,这表明其他途径的涌入。响应于 BRAF 和 PI3K 突变,Cyclin D 可能上调,这分别导致 CCND1 基因转录和 mRNA 翻译的增加。
有趣的是,正如 Curtin 等人在 2005 年所展示的那样。不同类型的黑色素瘤呈现不同的畸变,表明黑色素瘤发展/进展的机制、生物学行为和对靶向治疗的反应之间存在密切联系。
此外,紫外线辐射与 p16 ink4A -cyclin D-CDK4/6-RB 途径双重交织。临床前证据表明,紫外线可以诱导 p16 ink4A表达用于紫外线损伤修复,并通过促进 p16 丢失或 CDK6 扩增来增强黑色素瘤形成。
4、CDK4/6 抑制剂的药理学
帕博西尼、瑞博西尼 和 玻玛西尼 是第三代口服 CDK4/6 抑制剂。通过与无活性激酶的 ATP 口袋的竞争性和可逆性结合,强烈抑制 CDK4 和 CDK6,防止 RB 过度磷酸化,从而导致细胞周期停滞。表格1) [ 40 ]。这些药物对其他 CDK 家族成员的抑制作用很小或不存在:这导致与广谱 CDK 阻断相关的不良事件减少,正如第一代和第二代 CDK 抑制剂所观察到的那样。
表1:帕博西尼、瑞博西尼 和 玻玛西尼 的药理学特征。
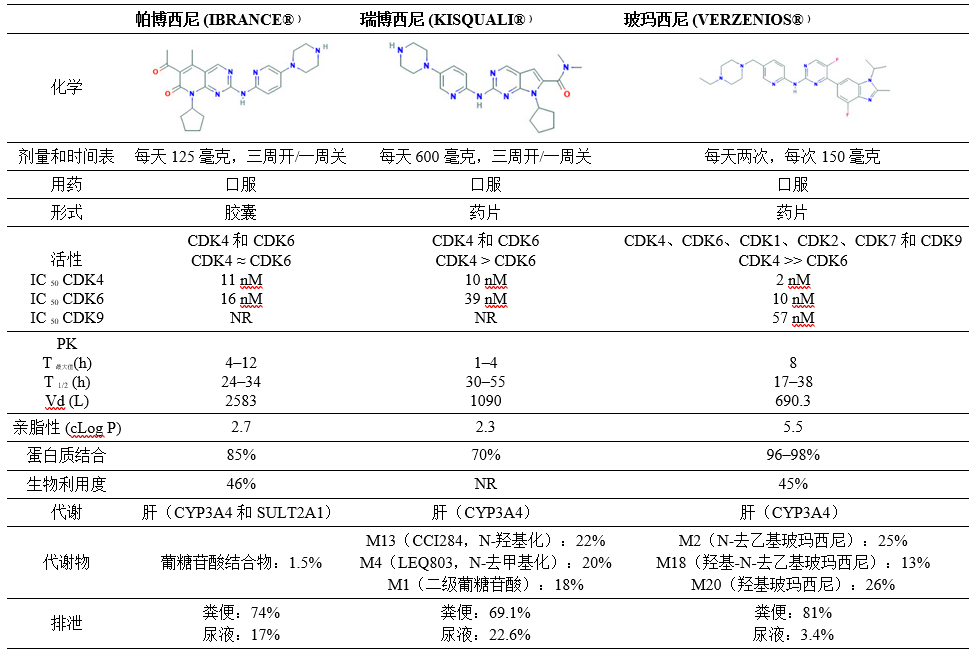
虽然 CDK4 和 CDK6 的 帕博西尼 抑制活性相似,但 瑞博西尼 和 玻玛西尼 对 CDK4 的选择性高于 CDK6。玻玛西尼 在这些药物中显示出更高的抑制剂效力,尤其是对 CDK4。此外,它已显示出对其他细胞周期蛋白依赖性激酶如 CDK1、CDK2、CDK7 和特别是 CDK9 的体外活性,而且还显示出对参与细胞增殖和存活的其他途径的体外活性。假设临床相关性,这些选择性和 CDK 抑制率的差异可能导致不同的安全性和剂量方案。这三种药物与血液学和胃肠道不良事件有关,因为在高度增殖的组织(如骨髓和胃肠道粘膜)中会抑制细胞周期。特别是,靶向 CDK6 与由于细胞抑制作用引起的造血改变有关。因此,虽然 帕博西尼 和 瑞博西尼 经常导致白细胞减少、中性粒细胞减少和贫血,但 玻玛西尼 对 CDK4 具有更高的选择性,导致血液学毒性更小,并且主要与胃肠道疾病有关,如恶心和腹泻,可能由 CDK9 抑制介导。其他令人担忧的副作用是血栓栓塞风险增加,瑞博西尼 与延长 QT 间期和肝毒性有关。
这三种不同的 CDK4/6 抑制剂显示出相似的药代动力学特征。然而,在口服给药后,与 玻玛西尼 和 帕博西尼 相比,瑞博西尼 被更快地吸收,最后一个显示出更长的最大浓度时间 (T max )。帕博西尼 的吸收受食物摄入和胃部 pH 值的影响,在空腹条件下服用 帕博西尼 或与质子泵抑制剂联合使用的患者中观察到较低的药物浓度水平。相反,瑞博西尼 和 玻玛西尼 的吸收不受食物摄入的显着影响,尽管高脂肪和高热量膳食略微增加 玻玛西尼 血浆浓度。与其他 CDK 4/6 抑制剂相比,玻玛西尼 显示出更短的平均半衰期 (T 1/2 ),因此需要更频繁的给药以维持能够维持细胞周期停滞的稳定血浆水平。
帕博西尼 和 瑞博西尼 由于与人血浆蛋白的适度结合而呈现出更高的分布体积。同时,正如在一些临床和临床前研究中所观察到的那样,玻玛西尼 显示出更高的亲脂性并更有效地穿透血脑屏障。此外,帕博西尼 和 瑞博西尼 都是乳腺癌耐药蛋白 (BCRP; ABCG2) 和 P-糖蛋白 (P-gp; ABCB1) 的底物,这两种外排转运蛋白负责去除脑脊液药物。
这些药物经受主要由 CYP3A4 介导的肝脏代谢。因此,同时使用强效 CYP3A4 抑制剂或特定基因多态性的存在可导致更高的 CDK4/6 抑制剂血液水平,并增加毒性风险,从而影响临床实践。
5、CDK4/6 抑制剂在黑色素瘤中的临床前活性
5.1 CDK4/6 抑制剂作为单一药物
由于 CDK4/6 通路在黑色素瘤中经常失调,因此可以预期 CDK4/6 抑制剂对这种疾病具有高度的活性。与直觉相反,临床数据证明这些药物单独使用时作用有限,表明黑色素瘤对 CDK4/6 抑制剂具有内在抗性(见下文)。尽管关于确切的耐药机制尚无明确结论,但一些临床前研究已经阐明了这一主题。
CDK4/6 抑制剂的耐药机制
已经提出了几种对 CDK4/6 抑制剂的抗性机制。一种推定的抗性机制存在于 PI3K-AKT-mTOR 信号级联中。例如,在 Hayes 等人的优雅研究中,通过基因表达和基因沉默系统,显示受体酪氨酸激酶 (RTK)-PI3K-AKT-mTOR 通路活性损害黑色素瘤细胞的敏感性到 帕博西尼。同样,吉田等人。证明增加的 mTOR 信号传导驱动对 CDK4/6 抑制剂的抗性。值得注意的是,RB 的丢失和 FXR1 的过表达似乎都导致 SLC36A1 水平的增加,这反过来又促进了 mTOR 信号传导。
另一个推定的耐药机制源于 p21 的活性降低。详细地说,在用 CDK4/6 抑制剂治疗后,黑色素瘤细胞会增加细胞周期蛋白 D1 的水平,细胞周期蛋白 D1 是细胞周期进程的主要调节剂。反过来,细胞周期蛋白 D1 隔离 p21 和其他 CDK 抑制剂(例如 p27)。由于 p53 转录调节 p21,Vilgem 等人。试图通过抑制 MDM2(一种 p53 降解剂)来增加 p21 水平。事实上,MDM2 抑制剂和 CDK4/6 抑制剂的共同给药导致肿瘤消退。MDM2 对 CDK4/6 抑制剂的拮抗作用也被其他人证实。同样,p53 降解剂 MDM4 也显示出对抗 CDK4/6 抑制剂的拮抗作用。
总的来说,这些数据表明结合 mTOR 抑制剂和/或 MDM2/MDM4 抑制剂可能会克服黑色素瘤对 CDK4/6 抑制剂的内在耐药性。所有这些药物都已经在临床上可用。此外,来自其他癌症类型的数据表明了更多推定的耐药机制:CDK4/6 过表达、p16 扩增、FGFR通路的上调、Hippo 通路的改变、CDK2 的激活、自噬和表观遗传改变。
5.2. CDK4/6 抑制剂联合免疫疗法
免疫疗法已经深刻改变了治疗黑色素瘤的方式。事实上,它可以实现非常长期的疾病控制甚至疾病缓解。然而,只有一小部分 (35-60%) 的患者对这种疗法有反应,其中近 40% 的患者在三年内对免疫疗法产生了耐药性。人们对提高疗效或降低对免疫疗法的抵抗力的化合物越来越感兴趣。CDK4/6 抑制剂是一种很有前途的药物类别,与免疫疗法显示出有趣的协同作用。
张等人。表明,CDK4/6 抑制可以刺激 PD-L1 表达,进而削弱抗肿瘤免疫并减少肿瘤浸润淋巴细胞。然而,CDK4/6 抑制剂与抗 PD-1 免疫疗法的共同给药增强了小鼠癌症模型中的肿瘤消退和总体存活率。同样,Yu 等人。报道 CDK4 通路异常赋予抗 PD-1 免疫治疗的内在抗性,这些结果在 85 名黑色素瘤患者的队列中得到验证。此外,与单一疗法相比,他们显示抗 PD-1 抗体与 帕博西尼 组合的疗效增强。一致地,Jerby-Arnon 等人。以优雅的方式证明了 CDK4/6 抑制剂的促免疫原潜力。特别是,通过对 33 个黑色素瘤的单细胞 RNA 测序,表明冷肿瘤生态位的特征在于与 T 细胞排斥和免疫逃避相关的抗性转录组学特征。该程序预测免疫治疗的临床反应降低,可以通过 CDK4/6 抑制来恢复。
从机制的角度来看,已经描述了 CDK4/6 抑制剂的几种推定的促炎活性。其中,三个可能与黑色素瘤特别相关。首先,CDK4/6 抑制剂已被证明可以增加 III 型干扰素的产生和癌症抗原呈递。其次,CDK4/6 抑制剂可以抑制调节性 T 细胞增殖,间接增强抗癌免疫监视。第三,CDK4/6 抑制剂显着增加 T 细胞活化和功能,直接增强抗癌免疫功能。
综合而言,临床前数据表明 CDK4/6 抑制剂和免疫疗法具有良好的协同潜力。验证性临床试验正在进行中(见下文)。
5.3. CDK4/6 抑制剂与 BRAF/MEK 抑制剂联合使用
近 50% 的黑色素瘤在 BRAF 基因中存在突变,并且 BRAF 抑制剂在该亚组患者中显示出巨大的疗效。然而,对 BRAF 抑制的抗性很快出现。为了延缓癌症进展,BRAF 和 MEK 抑制剂的组合已被证明可以提高反应率和反应持续时间。然而,对这种疗法产生获得性耐药是一个常见问题,通常源于 MAPK 通路的重新激活,这可能刺激 CDK4/6 信号传导。事实上,临床前证据支持联合抑制 RAF/MEK 和 CDK4/6。从分子的角度来看,已经提出了几种联合 BRAF/MEK 和 CDK4/6 抑制的协同作用机制。
吉田等人。表明长期抑制 CDK4/6 信号可以通过诱导衰老状态来克服对 BRAF 抑制剂的抗性。由于衰老以前与免疫系统增加的癌症清除率有关,Teh 等人。已经评估了联合 CDK4/6-MEK 抑制剂可能的免疫刺激作用。事实上,他们发现这种组合增加了肿瘤免疫原性、肿瘤内 CD8 T 细胞募集和 CD137L(免疫细胞上的 T 细胞共刺激分子)的表达。
CDK4/6-与BRAF/MEK-抑制剂的组合可以利用的另一种机制是RB/cyclin D1轴。特别是,CDK4/6 抑制剂 玻玛西尼 可以通过部分抑制 RB 磷酸化来损害细胞周期进程。然而,作为一种补偿效应,cyclin D1 水平会增加。将 LY3009120(一种泛 RAF 抑制剂)与 玻玛西尼 联合治疗可完全抑制 RB 磷酸化并降低细胞周期蛋白 D1 水平,从而导致细胞周期明显停滞。由 CDK4 抑制引起的 BRAF 降解增加至少可以部分解释联合治疗的协同效应。值得注意的是,与在肿瘤获得 BRAF/MEK 抑制剂耐药性后添加 CDK4/6 抑制剂相比,前期三联疗法(CDK4/6-BRAF-MEK 抑制剂)可能具有更好的疗效。
值得注意的是,NRAS 突变黑色素瘤似乎对 CDK4/6/BRAF/MEK 联合抑制特别敏感。例如,在 Kwong 等人的出色工作中,表明在 NRAS 突变的黑色素瘤中,MEK 的药理学抑制可以导致细胞凋亡,但不会导致细胞周期停滞,因为它会在 NRAS 活性消除后发生。然而,MEK 和 CDK4 的联合抑制取代了这种差异,导致治疗效果显着提高。
最后,一些初步证据表明,增加的 mTOR 信号传导可能会导致对 CDK4/6/BRAF/MEK 三联疗法的耐药性。
综合来看,CDK4/6 和 BRAF/MEK 轴的联合抑制显示出临床前令人鼓舞的结果。验证性临床试验正在进行中(见下文)。
6、CDK4/6 抑制剂在黑色素瘤中的临床活性
多项临床试验评估了 CDK4/6 抑制剂作为单药方案或与 BRAF ± MEK 抑制剂联合作为晚期实体瘤(包括黑色素瘤)患者的一线或后续治疗方案。表 2)。
表 2:CDK4/k 抑制剂在黑色素瘤中的临床证据。
|
药品 |
证据 |
患者数量 |
NCT号码 |
|
玻玛西尼 |
I 期剂量递增和肿瘤特异性队列研究。主要目标:安全性和耐受性。次要目标:药代动力学、评估生物标志物、抗肿瘤活性,并建立推荐剂量范围 |
共 225 个 |
NCT01394016 |
|
玻玛西尼 |
第 2 阶段,非随机研究。主要终点:客观颅内反应率。次要终点:颅内临床获益、PFS、OS 和安全性。 |
共 51 例 |
NCT02308020 |
|
帕博西尼 |
第一阶段,剂量寻找,非比较研究。主要目标:安全性、确定剂量限制毒性 (DLT)、最大给药剂量和最大耐受剂量 (MTD),并确定 II 期研究的推荐剂量 (RP2D)。次要目标:单剂量和稳态药代动力学 (PK) 的表征和初步抗肿瘤活性的评估。 |
共 33 个 |
|
|
帕博西尼 |
第一阶段,剂量寻找,非比较研究。主要目标:安全性、DLT、最大给药剂量、MTD。次要目标:单剂量和 PK 的表征以及初步抗肿瘤活性的评估 |
共 41 个 |
NCT00141297 |
|
帕博西尼 |
II 期,开放标签研究。主要终点:ORR。次要终点:OS、PFS、安全性 |
15 |
NCT03454919 |
|
帕博西尼 |
案例报告 |
2 |
|
|
瑞博西尼 |
第一阶段,剂量递增研究。 |
共 132 个 |
NCT01237236 |
|
瑞博西尼 和 Binimetinib |
LEE011 + binimetinib 的 1b/2 期研究。主要目标:估计 MTD/RP2D。次要目标:安全性、PK 和有效性。 |
14 |
NCT01781572 |
|
瑞博西尼 和 Encorafenib |
阶段 1b/2。主要目标安全性和有效性 |
18 |
NCT01777776 |
|
瑞博西尼、Encorafenib 和 Binimetinib |
1b 期,多中心研究,主要目标:MTD、DLT 和 ORR |
63 |
NCT01543698 |
|
帕博西尼和维罗非尼 |
I-II 期,多中心研究。主要目标 DLT,次要目标:疗效、耐受性和一年生存率 |
99 |
NCT02202200 |
6.1. CDK4/6 抑制剂作为单一药物
Patnaik 及其同事在一项 I 期研究中测试了 玻玛西尼,该研究招募了受不同癌症类型影响的患者,如乳腺癌、非小细胞肺癌、胶质母细胞瘤、黑色素瘤和结肠直肠癌。他们在 225 名患者中评估了 玻玛西尼 的安全性、药代动力学和药效学特征以及抗肿瘤活性。其中,26例诊断为晚期黑色素瘤:1例患者达到RECIST部分缓解(PR),6例患者病情稳定(SD),总体疾病控制率为27%。获得 PR 的转移性黑色素瘤患者的肿瘤具有诱导异常 CDK4 和 CDK6 激活的分子改变(NRAS 突变和 INK4 基因座的拷贝数丢失)。Sahebjam 等人随后研究了 玻玛西尼。用于非小细胞肺癌和黑色素瘤脑转移的患者。他们在该人群中表现出有限的颅内活动。事实上,没有观察到确认的颅内反应(两个队列的客观颅内反应率为 0%)。基于疗效结果,作者得出结论,在该患者群体中无需对 玻玛西尼 单药治疗进行进一步研究。
在 Rb 阳性实体瘤和非霍奇金淋巴瘤中进行的两项 1 期试验中观察到了 帕博西尼 的治疗益处。这些研究分别涉及 33 名和 41 名患者,其中包括 4 名和 6 名被诊断患有黑色素瘤的患者。总体而言,没有黑色素瘤患者达到 PR,而在两项研究中,一名黑色素瘤患者记录到 SD。
帕博西尼 的抗肿瘤活性也在一项试验中进行了测试,该试验证明在患有肢端黑色素瘤和 CDK 通路基因异常的患者中具有初步活性。唐等人。描述了两个接受 帕博西尼 的具有 CDK4 通路相关基因拷贝数变异的黑色素瘤患者的病例报告。尽管在这些患者中没有观察到完全或部分反应,但在化疗或免疫治疗失败后,疾病得到控制超过六个月,表明 CDK4 途径是一个潜在的治疗靶点。
在另一项 I 期剂量递增研究中,瑞博西尼 作为单一药物用于野生型 RB 晚期实体瘤或淋巴瘤患者,旨在评估安全性、药代动力学、药效学和初步活性。总体而言,共招募了 132 名患者:超过一半的患者之前接受过放射治疗,近四分之三的患者之前接受过两次或以上的全身治疗。3 人被诊断出患有黑色素瘤,1 人获得了 PR。
6.2. CDK4/6 与其他药剂合用
CDK4/6 抑制剂与靶向治疗相关的疗效已经在几项试验中进行了测试,主要是 I 期或 II 期试验,结果很有趣。
瑞博西尼 与 Binimetinib(NRAS/MEK 抑制剂)或 Encorafenib(BRAF 抑制剂) 进行了评估 在晚期 NRAS 和 BRAF 突变黑色素瘤的两个不同的 I/II 期临床试验中。Sosman 等人在 ASCO 2014 上以摘要形式介绍了 瑞博西尼 和 Binimetinib 组合的初步结果。招募了 14 名预先治疗的患者,每天一次服用 瑞博西尼,持续 21 天,而每天两次连续服用 Binimetinib。这种组合显示出有趣的抗肿瘤活性和安全性,事实上,六名患者获得了 PR(43%),六名患者获得了 SD。几名患者经历了早期肿瘤缩小,症状明显改善。最常见的治疗相关毒性是磷酸激酶升高、肌酐升高、痤疮样皮疹、恶心、水肿、白细胞减少和中性粒细胞减少。反过来,瑞博西尼 和 Encorafenib 在未接受过或预先治疗的患者(中位三个先前方案)中表现出临床活性和可接受的耐受性。瑞博西尼 的给药时间为三周和一周,而 Encorafenib 则连续给药。在可评估反应的 9 名患者中,2 名 PR 和 5 名 SD,其中 3 名是 BRAF 抑制剂初治和 3 名 BRAF 抑制剂预处理。登记的主要不良事件是掌跖角化过度、潮红、瘙痒、皮疹、脱发、皮肤干燥、味觉障碍、疲劳、肌痛和恶心。
Ascierto 等人将评估 BRAF 和 MEK 抑制剂三联疗法(Encorafenib 加 Binimetinib 与 瑞博西尼 相关)的 IB/II 期剂量递增研究的初步结果作为摘要提交。在 ASCO 2017。该试验招募了患有 BRAF-V600 突变实体瘤的患者。三联疗法在 BRAF-V600 黑色素瘤患者中进行了测试,这些患者之前未接受过 BRAF 抑制剂治疗。超过一半的患者 (52.4%) 显示肿瘤大小减小,包括四个完全缓解 (CR)、18 个 PR 和 15 个 SD。中位 PFS 为 9 个月。没有报告剂量限制性毒性。最常见的不良事件是中性粒细胞减少、丙氨酸转氨酶升高、腹泻和贫血。
最后,帕博西尼 和 Vemurafenib 在一项开放标签的 I-II 期试验中进行了测试,该试验涉及 IIIC 或 IV 期 BRAF-V600 E/K患者具有 CDKN2A 缺失和野生型 RB1 表达的突变转移性黑色素瘤。本研究旨在确定与 Vemurafenib 相关的 Palbocliclib 的最大耐受剂量。帕博西尼 的时间表是 14 天和 7 天,而 Vemurafenib 每天连续服用两次。次要终点包括最佳反应、OS 和 PFS。根据先前的 BRAF 抑制剂治疗将患者分为两组(第 1 组:否与第 2 组:是)。BRAF 抑制剂预处理患者的总体反应率为 25%,SD 为 50%。有趣的是,第 2 组的中位 PFS 和 OS 分别为 9.3 个月和 13.2 个月。因此,作者得出结论,在经过大量预处理的黑色素瘤患者中获得了显着的临床益处。
关于免疫疗法,评估 CDK4/6 抑制剂和免疫疗法联合治疗晚期实体瘤(包括黑色素瘤)的临床试验正在进行中。如前所述,有一些协同作用的临床前证据。
这些数据将有助于拓宽晚期黑色素瘤患者的治疗范围。
7、在黑色素瘤中使用 CDK4/6 抑制剂进行的临床试验
为了概述使用 CDK 4/6 抑制剂进行的黑色素瘤临床试验的当前趋势,肿瘤靶向药物基因检测的应用研究组在clinicaltrials.gov 上进行了关键字驱动的搜索(分别为 帕博西尼、瑞博西尼 和 玻玛西尼 的化合物、分子和商业名称,限制用于黑色素瘤恶性肿瘤)并手动注释感兴趣的试验。肿瘤靶向药物基因检测的应用研究组仅纳入了在不适合根治性局部区域治疗的转移性和晚期环境中进行的临床试验,包括皮肤和粘膜变异,并且无论 BRAF 和 NRAS 突变状态如何。CDK 4/6 抑制剂给药可以安排为一线或后续治疗,无论是在单一药物治疗中还是在联合治疗中。
尽管确定了九项临床试验,但其中六项专门针对黑色素瘤疾病进行,因此被认为具有更大的兴趣:四项是 II 期,一项是 I 期,而一项试验是 I/II 期研究。因此,计划的入组患者数量从低到中等。客观缓解率 (ORR) 是大部分 II 期研究(四分之三)的主要终点,而 I 期试验侧重于所研究药物的安全性和剂量限制毒性 (DLT)。表3)。
表3:正在进行的 CDK4/6 抑制剂治疗黑色素瘤的临床试验。DLTs = 剂量列表毒性;* 黑色素瘤和 BRAF 和 KRAS 突变的非小细胞肺癌。
|
研究编号 |
阶段 |
环境 |
用以研究的药物 |
病人数量 |
主要结果 |
当前状态 |
预计结束 |
|
黑色素瘤特异性研究 |
|||||||
|
NCT04720768 |
Ⅰb/Ⅱ |
转移性或不可切除的未经治疗或先前治疗过的黑色素瘤 BRAF V600 突变体 |
Encorafenib + Binimetinib + 帕博西尼 |
78 |
DLTs |
招聘 |
2023 年 12 月 |
|
NCT02974725 * |
Ⅰb |
转移性或晚期皮肤黑色素瘤 NRAS 突变体 |
LXH254 + 瑞博西尼 |
331 |
DLTs和安全 |
招聘 |
2022 年 5 月 |
|
NCT02159066 |
II |
转移性或不可切除的黑色素瘤 BRAF V600 突变体进展为先前的 Encorafenib + Binimetinib |
Encorafenib + Binimetinib + 瑞博西尼 |
160 |
ORR |
主动,不招人 |
2022 年 1 月 |
|
NCT04417621 |
II |
转移性或不可切除的先前治疗过的黑色素瘤 BRAF V600 或 NRAS 突变体 |
LXH254 + 瑞博西尼 |
320 |
ORR |
招聘 |
2023 年 4 月 |
|
NCT03484923 |
II |
转移性或不可切除的先前治疗过的黑色素瘤 |
斯巴达珠单抗 + 瑞博西尼 |
195 |
ORR |
招聘 |
2022 年 6 月 |
|
NCT02645149 |
II |
转移性或不可切除的黑色素瘤 |
曲美替尼 + 瑞博西尼 |
1000 |
BRAF/NRAS wt 转移性黑色素瘤的遗传异常类型和频率以及接受靶向治疗的 BRAF/NRAS wt 比例 |
尚未招募(2021 年 5 月) |
2028 年 12 月 |
|
非黑色素瘤特异性研究 |
|||||||
|
NCT02465060 |
II |
转移性或复发性先前治疗过的黑色素瘤 |
帕博西尼 |
6452 |
ORR |
招聘 |
2022 年 6 月 |
|
NCT02857270 |
I |
转移性黑色素瘤 NRAS 或 BRAF 突变体进展为靶向治疗 |
LY3214996 + 玻玛西尼 |
245 |
LY3214996 DLT |
招募 |
2021 年 9 月 |
|
NCT02791334 |
I |
转移性皮肤黑色素瘤 |
LY3300054 + 玻玛西尼 |
215 |
LY3300054 分布式账本技术 |
主动,不招人 |
2021 年 12 月 |
两项研究旨在评估与 瑞博西尼 和 LXH254(一种在 MAPK 驱动的肿瘤模型中具有抗肿瘤活性的 BRAF 和 CRAF 抑制剂)联合治疗期间的 DLT 和 ORR(分别为NCT02974725和NCT04417621 )。第一项试验目前正在招募 NRAS 突变皮肤黑色素瘤和在标准护理治疗后进展的 KRAS 或 BRAF 突变非小细胞肺癌,而第二项试验侧重于预处理的 BRAF 或 NRAS 突变黑色素瘤。
据肿瘤靶向药物基因检测的应用研究组所知,PLATform 研究 ( NCT03484923 ) 是唯一一项正在进行的临床试验,其中 CDK 4/6 抑制剂联合抗 PD-1 药物专注于黑色素瘤疾病。在这项研究中,既往治疗过的不可切除或转移性黑色素瘤患者(包括突变型和野生型 BRAF)随机接受斯巴达珠单抗联合 瑞博西尼、Capmatinib、Canakinumab 和 LAG525 之间的第二种药物。
CELEBRATE ( NCT04720768 ) 和 LOGIC-2 ( NCT02159066 ) 试验正在有趣地评估 Encorafenib 和 Binimetinib 加 CDK 4/6 抑制剂在 BRAF V600 阳性患者中的三药方案。CELEBRATE 研究承认接受过 BRAF 和 MEK 抑制剂联合治疗的幼稚和先前接受过治疗的患者,但也接受检查点抑制剂或化疗的患者。在 LOGIC-2 试验中,进展为一线 Encorafenib 和 Benimetinib 的患者继续联合治疗,并根据黑色素瘤基因谱被分配添加第三种药物(包括 瑞博西尼)。
MATCH ( NCT02465060 ) 和 MatchMel ( NCT02645149 ) 研究中也提出了一种突变驱动的方法。第二个专注于黑色素瘤患者。在这项试验中,接受标准治疗的 BRAF 和 NRAS 野生型患者接受全面的基因检测,然后分配到与其基因结果相匹配的靶向治疗。已计划对患有 CCND1、CDK4/6、CDKN2A 或 RAS 突变的患者使用 瑞博西尼 加曲美替尼进行治疗。
正如在其他恶性肿瘤中观察到的那样,在精准医学时代,越来越倾向于根据癌症基因谱个性化肿瘤治疗,因此,如上所述,在黑色素瘤环境中的不同研究也在朝着这个方向发展。
值得注意的是,只有一项试验包括一小群未接受过治疗的患者,而目前的趋势是在标准一线治疗失败后研究 CDK 4/6 抑制剂与其他药物的关联。最后,将 CDK4/6 抑制剂与新型药物如 LXH254 和 LY3214996(一种 ERK 1/2 抑制剂)相结合的研究结果备受期待。
8、靶向药物基因检测评论
尽管黑色素瘤治疗有显着改善,但仍迫切需要新的有效化合物。CDK4/6 抑制剂已经彻底改变了其他癌症的治疗,尤其是乳腺癌。尽管它们在黑色素瘤中的临床应用是可能的,但需要更多的研究来确认它们的相关性,以便将这些药物纳入临床实践。然而,从目前可用的证据来看,CDK4/6 抑制剂的单一疗法可能最多只能提供适度的益处。相反,在 BRAF/MEK 抑制剂或抗 PD1 治疗中添加 CDK4/6 抑制剂可能会带来显着的益处。评估联合方案的毒性和发现 CDK4/6 抑制剂功效的可靠预测生物标志物将特别重要。
(责任编辑:admin)


