【佳学基因检测】检测 SARS-CoV-2 病毒颗粒的等离子体方法
SARS-CoV-2病毒颗粒基因检测导读
由严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 引起的持续高度传染性的 2019 年冠状病毒病 (COVID-19) 大流行,通过区分感染者和非感染者,强调了诊断检测在疫情控制中的基本地位-感染人群。COVID-19 的诊断主要基于逆转录 PCR (RT-PCR),识别病毒的遗传物质。除了通过感知 SARS-CoV-2 特定结构蛋白(例如刺突糖蛋白(S1、S2)和核衣壳(N)蛋白)的病毒颗粒的存在来对患者进行感染性测试外,还大量提出了分子测试方法。虽然 S1 蛋白仍然是感染后中和抗体治疗的主要目标,也是疫苗和治疗设计的重点,它也已成为开发即时检测 (POCT) 设备的主要目标。本综述将重点关注基于表面等离子共振 (SPR) 的传感平台将 SARS-CoV-2 病毒颗粒的受体结合事件转换为可测量信号的可能性。将提供最先进的基于 SPR 的 SARS-CoV-2 传感设备,并将重点讨论等离子体传感器作为 POCT 对病毒颗粒和病毒蛋白传感的适用性。
SARS-CoV-2 病毒颗粒关键词:
SARSC-CoV-2,诊断,表面等离子共振(SPR),刺突蛋白,即时检测
-
简介
感染最近的冠状病毒 COVID-19 会导致严重的疾病,这源于宿主的免疫反应,尤其是促炎细胞因子风暴的释放。这种细胞因子风暴会产生极端的炎症和免疫反应,尤其是在肺部,导致急性呼吸窘迫。希望导致 COVID-19 的病毒 SARS-CoV-2 随着时间的推移成为地方病仍有待解决。广泛接种疫苗有助于减少感染和住院人数,最终减轻 COVID-19 的负担。疫苗在预防由这种传染病引起的死亡和住院方面发挥着关键作用,并有助于控制疾病的传播。然而,接种疫苗和未接种疫苗的人都需要时刻注意控制大流行所需的额外保护行为。实施了几项策略来对抗 COVID-19,包括戴口罩、手部卫生和保持社交距离。这些策略对 COVID-19 的影响在很大程度上仍不清楚。然而,最近的一项荟萃分析表明,使用面罩与出现导致 COVID-19 的病毒感染临床症状的风险降低 85% 相关。
除了疫苗接种和保护策略之外,对 COVID-19 感染者进行早期诊断已被证明对 COVID-19 大流行管理至关重要。检测 SARS-CoV-2 感染的主要方法主要有 3 种 。分子检测,例如聚合酶链式反应 (PCR) 方法,对于检测病毒 RNA 具有高度敏感性和特异性,建议用于那些有症状和激活公共卫生措施的人群。基于侧流的抗原快速检测分析检测病毒蛋白,虽然不如分子检测敏感,但具有便宜、快速和易于由任何人执行的优点。抗原快速检测检测,主要以侧流装置的形式,可作为一种公共卫生工具,用于筛查感染风险较高的个体,保护临床易感人群,确保安全旅行和复学和社会活动,并促进经济复苏 。实际上,常规检测的扩展依赖于快速、低基础设施检测或自我检测的发展,例如灵敏度与 PCR 相当的抗原快速检测。这种 COVID-19 诊断测试将继续在从大流行应对到大流行控制的过渡中发挥关键作用。
与 PCR 相比,对侧流抗原测试灵敏度降低的担忧导致考虑替代方法和概念。为了评估这些新诊断概念的质量,首先要根据要检测的每毫升最小病毒颗粒浓度来定义目标灵敏度,该值如何与每毫升噬菌斑形成单位 (PFU mL -1 ) 和RT-PCR对循环阈值 (C t ) 值的校正可能是什么。人们认为传染性在症状出现前 2-3 天开始,人们在症状出现时最具传染性(图1)。无症状和有症状的 SARS-CoV-2 感染可以具有不同的特征传播时间尺度,无症状个体的平均感染期约为 9-10 天 ,而有症状的感染期约为 1-4 天 。
 的相关性.jpg)
图1:Ct 值的临床意义以及与病毒 RNA 拷贝以及斑块形成单位 (PFU) 的相关性:( a ) 考虑到SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组自己和其他人的发现 的 SARS-CoV-2 感染性时间表。( b ) 在 COVID-19 患者的鼻咽拭子标本中,Ct 值随时间的变化而变化。( c ) Ct 计数与病毒 RNA 拷贝的相关性。( d ) 病毒 RNA 拷贝 mL -1的相关性用 SARS-CoV-2 的斑块形成单位 (PFU) 作为传染性的衡量标准。Vero E6 细胞被 10 倍稀释的 SARS-CoV-2 分离株 20A.EU2(EU 变体)感染。通过 Spearman 和 Karber 方法计算估计的病毒浓度,并表示为 TCID50/mL (1 pfu mL -1 = TCID50/mL × 0.7)。结果表示为每组至少三个独立测量值的平均值±SEM。
因此,考虑病毒诊断敏感性的一个基本问题与如何比较/关联从不同方案和病毒样本获得的 RT-PCR 中的循环阈值 (Ct) 值的问题 。这个练习仍然很复杂,因为只有了解患者的健康史才能正确解释 Ct 值 。在考虑 Ct 临界值和诊断敏感性时,构成传播风险的病毒载量范围的不确定性是另一个因素 。人们在症状出现时最具传染性(图1a),上呼吸道病毒载量最高的人群 。渐近个体遵循类似的动态,并以与症状前个体相同的方式对病毒传播做出贡献。普遍认为 Ct 值与 SARS-CoV-2 病毒载量有关,Ct 为 33-35 与低传染性有关,Ct 值 < 20 与高病毒载量有关,Ct = 40 为临界值在积极和消极识别的个体之间。最近,SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组中的一些人 [ 16 ] 使用来自 520 名 COVID-19 患者的数据证实了 SARS-CoV-2 RNA 的时间线(图1B)。与最高病毒载量相对应的最低 Ct 值在症状发作后早期记录,随后随着症状发作后时间的增加病毒载量下降。
为了将 Ct 值与病毒粒子的绝对数量相关联,可以并行确定病毒 RNA 拷贝的数量(图1C)。正如所料,观察到RT-PCR Ct值和病毒RNA拷贝mL -1之间的线性关系。因此,Ct 值对应于 2.1 × 10 3病毒 RNA mL -1,而 Ct = 12 对应于 7.1 × 10 9病毒 RNA mL -1. 病毒 RNA 的存在并不一定意味着感染性病毒粒子的存在。病毒粒子可能有缺陷(例如,通过突变)或可能已因环境条件失活。因此,使用病毒 RNA 拷贝作为传染性病毒颗粒数量的近似值会导致高估。在解释有关病毒载量的数据时,记住这一点很重要。然而,对于许多病毒来说,即使是小剂量的病毒粒子也会导致感染。例如,对于普通感冒,~0.1 TCID 50足以感染一半的暴露人群 。为了评估感染性病毒的浓度,50% 组织培养感染剂量与 1 PFU mL -1 = TCID 50/mL × 0.7 必须通过用稀释的病毒感染易感细胞的复制培养物并注意一半复制培养皿被感染的稀释度来确定。图1d表示2.1×10 3病毒颗粒mL -1不会产生可口的病毒。形成1 PFU mL -1的开始对应于(4.0±1.9)×10 4病毒颗粒mL -1的最小病毒颗粒载量。这与大约 Ct = 32 ± 1 相关。在 Pickering 等人最近的炒锅中。,30 的 Ct 值与 1 PFU mL -1和 5 × 10 4 RNA 病毒颗粒 mL -1相关。病毒颗粒载量与SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组的发现非常相关。Ct 值的差异与所使用的不同片段有关,即 Pickering 等人的 N 基因。 和SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组的 IP 目标。这种基准测试对于评估新的传感方法及其性能水平非常重要。对于 RT-PCR,每毫升 100 个病毒 RNA 拷贝对应于阳性结果。此外,血清学检测可以提供有关免疫反应的有价值信息,是对 SARS-CoV-2 RNA 检测的良好补充。事实上,随着患者的康复,病毒载量开始下降,而免疫球蛋白水平会增加,直到症状出现后约 10 天。在这个时间点可以进行血清学测试。
在大多数情况下,SARS-CoV-2 会导致轻微或无症状的疾病;然而,严重到危重的疾病发生在一小部分感染者身上,70岁以上的人发病率最高。与其他病毒相比,SARS-CoV-2 的繁殖率中等,为R 0 = 2.5,而SARS-CoV 和 1918 年流感大流行的R 0 = 2 0-3 0,MERS-CoV 的R 0 = 0·9对于 2009 年流感大流行 ,R 0 = 1·5]。一般而言,对于一种快速传播的疾病,例如 SARS-CoV-2,遏制其传播的最有效方法是早期发现以隔离患者。COVID-19 诊断的金标准是对从疑似个体的上呼吸道采集的鼻咽拭子中的病毒 RNA 进行基于核苷酸的检测 (qRT-PCR)。除了病毒 ssRNA,大多数 FDA 批准的商业抗原试剂盒都针对核衣壳(图 2)。
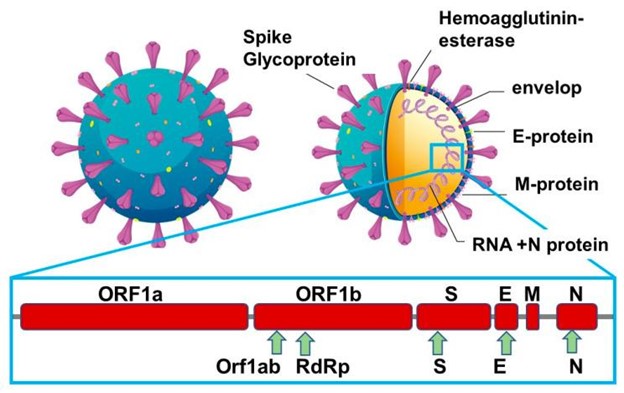
图 2:用于传感的 SARS-CoV-2 结构蛋白:病毒复制需要其他辅助基因,包括开放阅读框 1a (ORF1a)、ORF1b 和 RNA 依赖性 RNA 聚合酶 (RdRp)。
SARS-CoV-2 的结构蛋白紧挨着刺突糖蛋白(S1、S2)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。M蛋白是病毒颗粒上最丰富的蛋白质,E蛋白是病毒颗粒最小的主要结构蛋白。S包膜蛋白由两个功能亚基S1和S2组成;S1 亚基与宿主细胞受体结合,而 S2 亚基与病毒和细胞膜融合。S 蛋白仍然是感染后中和抗体治疗的主要目标,也是疫苗和治疗设计的重点。它也是开发诊断方法的主要目标,但尚未广泛整合到主要基于靶向核衣壳蛋白的商业抗原试剂盒中。N蛋白确实是主要的结构蛋白,负责病毒RNA的复制和转录,将包膜基因组包装成病毒颗粒,并与宿主细胞的细胞周期相互作用。它也是病毒感染期间产生和释放的最丰富的蛋白质,可以在感染的最初几个小时内在血清和尿液中检测到,在感染后约 10 天达到最大值。此外,每个 SARS-CoV-2 病毒粒子上仅存在约 100 个刺突三聚体,估计总共有 300 个单体,可作为传感的靶点,而每个病毒粒子中表达约 1000 个核衣壳拷贝。将包膜基因组包装成病毒颗粒并与宿主细胞的细胞周期相互作用。它也是病毒感染期间产生和释放的最丰富的蛋白质,可以在感染的最初几个小时内在血清和尿液中检测到,在感染后约 10 天达到最大值。此外,每个 SARS-CoV-2 病毒粒子上仅存在约 100 个刺突三聚体,估计总共有 300 个单体,可作为传感的靶点,而每个病毒粒子中表达约 1000 个核衣壳拷贝。将包膜基因组包装成病毒颗粒并与宿主细胞的细胞周期相互作用。它也是病毒感染期间产生和释放的最丰富的蛋白质,可以在感染的最初几个小时内在血清和尿液中检测到,在感染后约 10 天达到最大值。此外,每个 SARS-CoV-2 病毒粒子上仅存在约 100 个刺突三聚体,估计总共有 300 个单体,可作为传感的靶点,而每个病毒粒子中表达约 1000 个核衣壳拷贝。_ 最近在内部开发的 SARS-CoV-2 抗原测试和针对核衣壳蛋白的可比测试 中使用单克隆抗尖峰抗体 进行了比较,特别是使用了一种新型单克隆抗体亲和常数 K D= 0.7 海里。大多数商业化验中的抗原选择,核衣壳被证实具有比基于穗的化验更高的灵敏度。然而,基于尖峰的检测明显比基于核衣壳的检测更具特异性。由于已发现逃逸突变体表现在这些尖峰以及核衣壳蛋白中,因此在同一诊断设备上组合两种抗原可能是前进和加强 COVID-19 测试可靠性的方法,这是最近提出的一种方法蔡等人。那么,在使用 S 和 N 蛋白靶标的酶联免疫吸附测定 (ELISA) 和 PCR 的替代方案方面,SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组处于什么位置?
SARS-CoV-2 病毒颗粒的高效检测方法可以看作是对其他综述的补充,最近的临床样本结果 强调了便携式 SPR 作为病毒诊断设备的巨大潜力。特别关注 SPR 表征生物受体和 COVID-19 靶标之间亲和力常数的潜力,这一方面通常没有更详细地描述。然而,局部表面等离子共振 (LSPR) 传感器不会被讨论,大量信息可以在 Takemura 的论文中找到 。审查将主要关注 SPR 对 SARS-CoV-2 病毒颗粒的检测。虽然基因仍然是最广泛使用的病毒生物标志物之一,但已经实施了更灵敏、更新颖的病毒基因检测方法 ,例如CRISPR相关蛋白9与SPR ,SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组认为,如果在检测时进行以 SARS-CoV-2 蛋白(例如 S 和 N 蛋白)的存在为重点的分子检测,以识别那些在检测时被感染的个体,则在直接与传染性相关联方面更有效。定量或至少半定量的方式。在接下来的讨论中,将重点关注基于病毒粒子的 SPR 传感。
2. 表面等离子共振作为结合动力学分析的工具
生物配体开发的关键是了解生物受体与目标(分析物)之间的结合相互作用强度。经典的生化方法,例如蛋白质印迹和免疫共沉淀方法,只能判断生物分子之间是否发生结合。ELISA 提供更详细的信息,例如结合亲和力,但并非没有复杂且耗时的基于酶的扩增和标记步骤。SPR 的优势,可商用超过 30 年,是它以无标签的方式准确地揭示了结合相互作用。在经典的基于金棱镜的 SPR 方法中,该信息是通过将分析物流过用生物受体修饰的 SPR 棱镜获得的。由于生物受体-分析物相互作用,分析物在传感器表面的积累导致传感器表面附近的折射率增加,从而导致 SPR 条件实时变化,并在几分钟内提供有关结合效率的信息。该方法需要最少量的样品进行结合动力学实验,并在不使用荧光、磁性或放射性标记的情况下提供有关结合和解离事件速率的信息。可以使用不同的表面化学方法将少量不同的生物受体集成到 SPR 传感器上,从使用经典抗体和工程抗体 到 DNA 、适体 、糖 等。近年来,随着 SPR 分析的成本和复杂性大大降低负担得起的便携式 SPR 技术的出现。然而,直到最近的成就,SPR 方法仍然没有用于检测单个病毒颗粒和一般低病毒颗粒浓度。由于它们的快速检测和量化对于精确的疾病诊断仍然非常重要,例如 COVID-19,最近已经描述了在这个方向上的不同努力,并将在下面更详细地讨论。
SARS-CoV-2 病毒颗粒的等电点 pI 为 10.07,在生理 pH 值下带正电荷 。可能会发生与适体带负电荷的骨架的非特异性相互作用,需要设计高度特异性的生物受体。少数针对刺突蛋白和 N 蛋白的 SARS-CoV-2 适体确实有报道。在这种情况下,SPR 被证明是了解受体结合域 (RBD) 与 SARS-CoV-2 的完整 S1 蛋白和表面生物受体之间亲和力的有效工具,优先固定在 SPR 表面芯片使结合动力学分析可与未来的等离子体传感相媲美。在 20 碱基适体“CFA0688T”(碱基对生物)的情况下,在 5' 末端用硫醇-TTT-TTT 修饰一个环,以赋予适体一些灵活性,使其锚定在金界面上,结合亲和力重组 SARS-CoV-2 S1 刺突蛋白测定为K D = 3.4 ± 0.2 nM (R 2 = 0.9985) (图 3A)。SARS-CoV-2 适体与金 SPR 芯片的连接是基于马来酰亚胺-硫醇化学,首先将 3-巯基丙酸偶联到金芯片上,然后是 EDC/NHS 连接马来酰亚胺-PEG 6-胺。图 3A)。
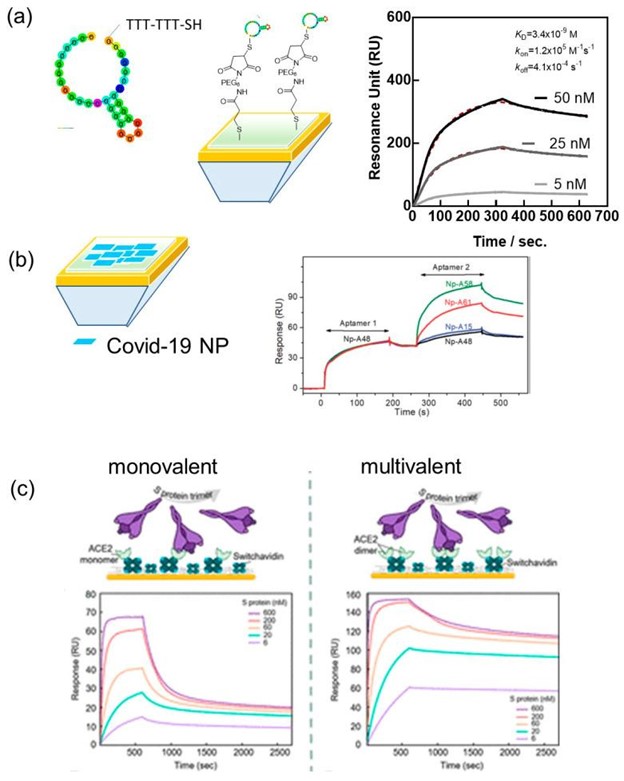
图 3:SPR 作为确定 SARS-CoV-2 生物受体和病毒蛋白之间亲和力的宝贵工具:( a ) S1 刺突蛋白与来自 BasePairBio 的 20 碱基适体“CFA0688T”的结合动力学的 SPR 传感图以及表面化学结构。( b ) N 蛋白特异性适体与 SARS-CoV-2 N 蛋白修饰的 SPR 芯片(使用 EDC/NHS 化学的 CM5 芯片)结合动力学的 SPR 传感图,传感器芯片上飞过一系列不同的适体(转载于来自 Ref. 的许可),2020,RSC,(c)单层和二聚体 ACE-2 修饰的 SPR 芯片的 SPR 分析示意图以及结合动力学(经 Ref. , 2021, ACS 许可转载)。
Zhang 等人报道了一个 58 碱基 N 蛋白特异性适体 (A48),K D为 0.49 nM,k on = 8.80 × 10 5 M -1 s -1和k off = 3.48 × 10 -4 s -1,由 SPR 确定。然而,在这个实验中,N 蛋白使用典型的 EDC/NHS 协议附着在表面上,并且适体在表面上流动(图 3B)。通过采用这种方法,可以评估不同适配体和 N 蛋白之间夹心型结合的可能性。在第一次运行中,适体 A48 飞过通道,导致 47 RU 的移位。在接下来的运行中,第二个特定于 N 蛋白的适体在同一通道上飞行。如果此适配体与蛋白质的不同表位结合,则响应信号应具有第二个平台,这在 A58、A61 中观察到,但在 A15 和 A48 作为对照时没有观察到。
同样,SPR 被用于对 SARS-CoV-2 刺突蛋白和人类受体血管紧张素转换酶 2 (ACE-2) 的亲和力诱导的亲和力增强的去卷积。事实上,与其他冠状病毒类似,SARS-CoV-2 包膜的糖基化刺突蛋白与宿主 ACE-2 受体结合,介导病毒颗粒与宿主细胞膜的融合。研究表明,与 SARS-CoV 相比,SARS-CoV-2 RBD 的嵌合结构对 ACE-2 具有更高的结合亲和力 。Geschinder 及其同事 指出,通常认为的分离的刺突蛋白 RBD 与单个 ACE-2 单体之间的 1:1 结合相互作用过于简单化,并没有考虑亲和力效应。通过设计有利于全长 S 蛋白和 ACE-2 之间的单价相互作用事件的传感器表面以及有利于产生多价效应的表面,K D在第一种情况下确定为 60 nM,而在多价情况下,信号占 125 nM 亲和力相互作用 (62%),但也占 4 nM 亲和力 (28%)。在下文中,单体和多聚体 ACE-2 物种与开关抗生物素蛋白修饰的 SPR 芯片相关联,从而可以解决每个表面上的多个结合事件。在二聚体 ACE-2 表面,观察到 283 pM 的高亲和力,主要是由于较低的k关闭率(图 3C)。
除了适体和 ACE-2,研究最广泛的 SARS-CoV-2 生物受体仍然是抗体和工程抗体。在这方面,纳米抗体引起了广泛的兴趣,SPR 主要用于获得它们对 RBD 和 SARS-CoV-2 的全长 S1 蛋白的亲和力特征。SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组选择 VHH-72 (PDB ID 6WAQ) ,一种抗 SARS-CoV-1 抗尖峰纳米体,可交叉中和 SARS-CoV-2,用于基于 SPR 的调查和传感。尽管 VHH-72 对 SARS-CoV-2 RBD 具有纳摩尔亲和力,快速解离被认为会对基于 SPR 的传感产生负面影响。此外,生物传感器的一个常见缺点是使用 EDC/NHS 将蛋白质(如 VHH-72)固定在传感器上。VHH-72 的随机附着最有可能降低大目标的结合效率,例如 SARS-CoV-2 病毒颗粒。免疫球蛋白或 Fab 片段是最喜欢的表面结合剂候选物,允许纳米抗体的识别表位朝向溶液,从而朝向病毒靶标。由于人 IgG1 的 Fc 结构域通过 HHHHHHRENLYFQG 接头与 VHH 结构域遗传连接,VHH-72-Fc 的二价导致纳摩尔亲和常数K D = 1.5 × 10 -9 M,k在1.2 × 10 5 M -1 s -1和改进的k off等于 1.8 × 10 -4 s -1 (图 4A)。
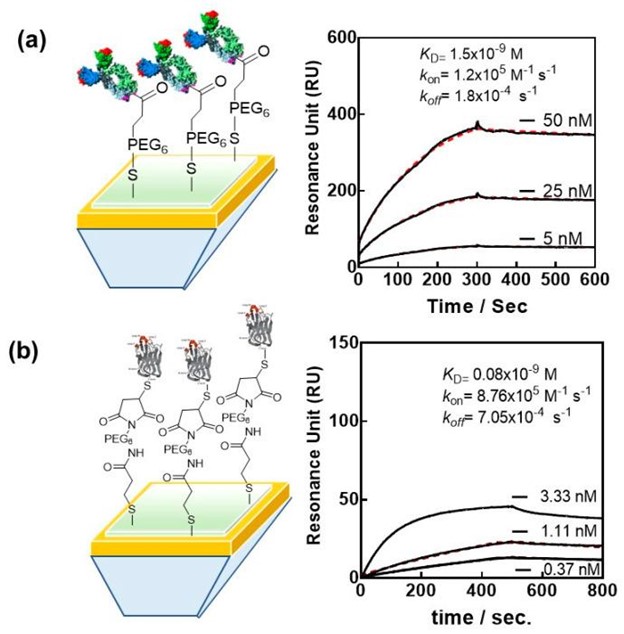
图 4:不同工程 SARS-CoV-2 抗体的亲和力:( a ) 纳米抗体 VHH-72-Fc 与传感图的定向连接(经 Ref. , 2022, RSC 许可转载)。( b ) nanoCLAMP P2712L (6His-P2710-linker-P2609-linker-Cys) 与武汉-RBD的结合亲和力。金芯片用马来酰亚胺接头修饰。运行缓冲液:20 mM MOPS、150 mM NaCl、1 mM CaCl 2和 1% BSA 作为封闭剂(pH 6.5)。黑线描绘绑定数据,红线显示 1:1 绑定模型拟合。
最近,新的 SARS-CoV-2 RBD 特异性抗体模拟物被称为 nanoCLAMP(纳米梭菌抗体模拟蛋白)与 SPR 。nanoCLAMP 源自透明质酸梭菌的免疫球蛋白样碳水化合物结合模块,是 4 nm × 2.5 nm 的抗体模拟物,与其他抗体模拟物和纳米抗体相比具有明显的优势。它们可以在短短 6 周内从幼稚的噬菌体展示文库中筛选出高特异性靶标亲和力。它们从大肠杆菌的胞质溶胶中产生价格便宜,产量超过 200 g/L。> 75°C的高熔点使其在室温下稳定,因此非常适合传感器开发,因为修改后的界面可以在室温下长时间储存而不会降低其传感性能。nanoCLAMP 中不存在其他半胱氨酸单元,使得基于半胱氨酸的表面附着特别容易,因为还原剂(如 DTT)不会改变蛋白质结合结构。最近测试了具有半胱氨酸末端的亲和力成熟 nanoCLAMP,nanoCLAMP P2712 (6His-P2710-linker-P2609-linker-Cys),武汉 RBD 的K D为 80 pM。图 4乙)。该配体通过其单个 C 端 Cys 共价结合到用马来酰亚胺单元修饰的金芯片上,此外,在用 6 M GuHCl/0.1 N NaOH 化学变性后,可以很容易地在表面上重新折叠。
3. SARS-CoV-2 的等离子体传感器
COVID -19 特异性和高亲和力生物标志物的开发不仅对治疗设计有用,而且已成为等离子 SARS-CoV-2 传感器的重要组成部分。SPR 的第一个例子,特别是基于强度调制的 SPR 病毒传感,是 Chang 等人报道的。。提出了一种基于抗体的 H7N9 病毒传感,检测限为 144 拷贝 mL -1,与使用相同抗体的自制靶标捕获 ELISA 相比,灵敏度提高了 20 倍。这些传统的 SPR 测试机器相当笨重,不适合在临床环境中实施。因此,在研究实验室中进行的 SPR 病毒检测方案很少被认为是可行的方法,并且可用于临床和护理点应用。Huang 等人提出了一种低成本的纳米等离子传感器,可以一步快速检测和量化 SARS-CoV-2 假病毒。该概念基于用抗体修饰的金纳米杯阵列。SARS-CoV-2 与它的附着会导致等离子共振波长和强度发生变化。与用 ACE-2 蛋白修饰的金纳米颗粒的进一步相互作用导致灵敏的夹心测定法,其传感能力范围为 10 2 –10 7 个病毒颗粒 mL -1,检测限为 370 个假病毒颗粒 mL -1 (表1) 15 分钟内 (图 5A)。石墨烯涂层 SPR 由 Akib 等人提出。用于 COVID 传感 ,主要关注石墨烯 SPR 优势的展示,而不是病毒样本的真实传感。
表1:不同SARS-CoV-2检测原理的比较
|
方法 |
配体目标 |
LoD |
参考 |
|
逆转录聚合酶链反应 |
核酸抗 ORF/N |
<10 |
|
|
实时灯 |
核酸对 N |
50 |
|
|
场效应管 |
S1抗体 |
242 |
|
|
纳米等离子体 |
ACE2 抗 S1/Au-NP 抗体 |
370 |
|
|
纸基 EC 传感器 |
核酸 |
6.9 × 10 3 |
|
|
便携式 EC 传感器 |
针对 S1 的纳米抗体 |
1.2×10 4 |
|
|
SPR |
针对 S1 的纳米抗体 |
5.9 × 10 4 |
|
|
侧向流动分析 |
N基因 |
3.0 × 10 6 |
|
EC = 电化学;GFET = 基于石墨烯的场效应晶体管;RT-LAMP:逆转录环介导的等温扩增。
图 5:应用于 SARS-CoV-2 传感的便携式 SPR 概念:( a ) 用于在三明治分析中检测 SARS-CoV-2 病毒颗粒的纳米等离子共振传感器原理以及已开发的传感器芯片盒的照片,该盒将插入到带有智能手机的手持设备,用于读取数据并将曲线与不同的 SARS-CoV-2 伪病毒颗粒浓度结合(经参考文献 , 2021, Elsevier 许可转载)。(b)(左)桌面 SPR 的图像具有基于墨盒的传感能力的 POC 测试设备。(中)培养的 SARS-CoV-2 病毒颗粒流经 VHH-72-Fc 修饰的基于墨盒的 SPR 芯片时的 SPR 传感图(图 4b)、含有 0.01 M HEPES、0.15 M NaCl 和 0.05% v / v表面活性剂 P20 的运行缓冲液 HBS-P + 1× 以及 RT-qPCR 阳性 (50) 和阴性 (69) 鼻咽样本和 SPR 数据之间的相关性. 阳性和阴性之间的截止值为 186 RIU(红线)。
正如 Jean-Francois Masson 最近的一篇评论所述,等离子传感器非常适合小型便携式诊断设备 。该领域最近从使用基于棱镜的方法发展到使用等离子体纳米材料、光纤和智能手机作为诊断系统中的光学组件 。实际上,等离子体装置可以在性能损失有限的情况下缩小规模,因为光学测量更依赖于波长或等离子体共振角位移而不是强度。因此,只要检测器的灵敏度不受影响,信噪比就会保持不变。使用廉价的发光二极管 (LED) 光源而不是激光与小型 USB 光谱仪 甚至智能手机用于读出使仪器便携且成本低。此外,传感器芯片可以在不损失分析灵敏度的情况下缩小尺寸,因为等离子体的传播长度在几十微米范围内。当使用一次性镀金底漆时,可以避免使用不整洁且会干扰光学读数的折射率匹配流体 。围绕样品处理,SPR 的成本及其复杂性仍有待提高。便携式设备中的流体处理应在低压下或什至不需要泵,例如将分析物被动运输到传感芯片。此外,即使对于便携式 SPR 设备,可重现和面向生物受体的表面化学仍然是针对每种分析物进行优化的最终步骤。深度学习和机器学习方法的整合以提高 SPR 的检测特性正在成为更快和可持续传感的重要和不可或缺的部分。已经报道了一些便携式等离子体设备,例如 Guner 等人的基于智能手机的 SPRI。,显示折射率变化低至 4.12 × 10 -5 RIU,与商业仪器的性能以及 PhotonicSys SPR H5 的小型化平台的性能相当、Affinité Instrument或Phaselab Instruments的相敏紧凑型 IPOS-Lab SPR 。在 Affinité Instrument 的情况下,光谱 SPR 信号中的最小值使用专有算法跟踪,该算法提供 0.004 nm 的最终仪器分辨率,噪声水平 < 5 RIU。
使用便携式 SPR 进行诊断也是 COVID-19 大流行期间研究的重点。SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组最近以感知 SARS-CoV-2 的 S1 蛋白的存在为例,举例说明了如何打破常规和便携式 SPR 在临床环境中实施的缺陷。为了演示如何实施便携式 SPR 技术以通过 S1 刺突蛋白感知 SARS-CoV-2 病毒颗粒,SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组最近重点关注了将 SPR 提升到 POC 测试水平的三个重要科技要素:一种对 SARS-CoV-2 的包膜 S1 蛋白具有高亲和力的工程抗体和传感盒的使用,这是实现最先进的即时传感的首要仪器考虑之一。图 4b)。用于预测阳性和阴性鼻咽拭子样本之间的截止值的机器学习的实施被证明对于提高传感器的性能也是必不可少的。当暴露于不同浓度的培养的 SARS-CoV-2 病毒颗粒(进化枝 20A.EU2,EU 变体)时,仍可将 5.9 × 10 4病毒颗粒 mL -1的样本与噪声区分开来,即 RU = 10 (图 5b),并与 Ct = 32 左右的 RT-qPCR 值相关。为了进一步推动分析,杀死 50% 的 Vero E6 细胞所需的病毒颗粒数量允许确定感染滴度,发现为 10 PFU mL -1用于 5.9 × 10 4病毒颗粒 mL -1。
此外,基于盒式传感器的临床性能还对 50 个鼻咽拭子样本(25 个阳性和 25 个阴性样本,通过从临床测试机构的患者收集的 RT-qPCR 鉴定)进行了评估。使用 186 RU 的截止值 (图 5b) 从经 RT-qPCR 确认为阳性的 50 份鼻拭子样本中,有 4 份被鉴定为 COVID-19 阳性。根据 RT-qPCR,在 25 个样本中正确识别出 21 个样本,确定了 84% 的阳性百分比一致性 (PPA)。在 RT-qPCR 确认为阴性的 25 个鼻样本中,有 6 个被 SPR 鉴定为阴性,显示 76% 的阴性百分比一致性 (NPA)。使用具有 250 毫秒采样时间和 1 分钟采集时间而不是 15 分钟的机器学习算法,仍然可以匹配相同的结果。有趣的是,基于墨盒的传感器的结果与使用微流体通道的 SPR 的结果相当。由于独特的灵敏度和与横向流动分析相当的响应时间,这项工作开辟了 SARS-CoV-2 感染的即时检测的可能性,并可能大大增加病毒诊断方案。
从这个和其他 COVID-19 SPR 传感器的性能与其他替代便携式传感方法的比较可以看出表1. 事实上,RT-PCR 仍然是病毒诊断最敏感的方法。比较使用相同表面配体的光学 和电化学传感器得出了相当的灵敏度。它们都优于基于横向流动的测定。
4. SARS-CoV-2 病毒颗粒结论和观点
目前,已经开发了各种商业 POCT 设备,用于检测早期流行病爆发。微流体、微电子机械系统技术、纳米技术和 3D 打印的创新进展,以及数据分析和高效表面配体的开发,在过去两年显着促进了 POCT 诊断的发展。POCT在全球范围内仍处于起步阶段,未来需要解决技术进步问题。这也适用于基于 SPR 的传感器。虽然仍然主要是基于研究的仪器,但便携式表面等离子体共振设备已被证明对当前的 SARS-CoV-2 大流行具有重要价值。SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组希望在这里展示传统 SPR 测试的一些缺点,诸如笨重的仪器及其在临床环境中难以实施的问题,已通过这种小型化方法部分克服。它们的小型化特性与足够的表面结构相结合,使其能够在 3 级生物安全条件下实施,以筛选新的生物受体对不同病毒表位的亲和力,并产生一些敏感的 SARS-CoV-2 诊断平台。凭借低至 10 PFU/mL 的可靠 SPR 测试,它们可以被视为侧流抗原测定的替代方案,其中最可靠的测试检测 50 PFU/mL 相当于约 3 × 10 它们的小型化特性与足够的表面结构相结合,使其能够在 3 级生物安全条件下实施,以筛选新的生物受体对不同病毒表位的亲和力,并产生一些敏感的 SARS-CoV-2 诊断平台。凭借低至 10 PFU/mL 的可靠 SPR 测试,它们可以被视为侧流抗原测定的替代方案,其中最可靠的测试检测 50 PFU/mL 相当于约 3 × 10 它们的小型化特性与足够的表面结构相结合,使其能够在 3 级生物安全条件下实施,以筛选新的生物受体对不同病毒表位的亲和力,并产生一些敏感的 SARS-CoV-2 诊断平台。凭借低至 10 PFU/mL 的可靠 SPR 测试,它们可以被视为侧流抗原测定的替代方案,其中最可靠的测试检测 50 PFU/mL 相当于约 3 × 106RNA 拷贝/mL。多通道和多分析物分析的可能性可能会在临床环境中为 SPR 提供额外的优势。在欧盟资助的项目 CorDial-S 下,至少以一种方法对临床性能进行了更密切的测试。对 119 份鼻咽拭子样本的评估达到了 88% 的阳性百分比一致性 (PPA) 和 92% 的阴性百分比一致性 (NPA)。传感器只能使用一次,因为表面的再生会导致性能下降,即 86% 的正百分比一致性 (PPA) 和 82% 的负百分比一致性 (NPA)。有趣的是,表面的再生主要对负样本产生了很大的影响,得到了假阳性反应。在重复使用的接口上筛选的 50 个阴性样本中,有 41 个被 RT-PCR 和 SPR 指定为阴性。
有了这些结果,SPR 在病毒检测中的观点是什么?基于 SPR 的生物传感器的液体样品体积和功耗仍然是生物医学应用的主要瓶颈。为了克服这些缺点,必须考虑改进和紧凑的微流体装置,如无动力泵系统,用于下一代基于 SPR 的集成生物传感器。使用传感盒是 Affinité Instruments 与SARS-CoV-2 病毒颗粒高效检测方法重点攻关课题组一起为减少昂贵泵的实施而进行的一项尝试。这些一次性 SPR 传感器是用于快速单点测量的低成本且易于使用的传感设备。如果超灵敏度成为一个重要参数,则需要在该领域将纳米材料集成到基于 SPR 的传感器中。将磁场整合到 SPR 中并使用磁性粒子可能是改进病毒传感的一种方式。最近研究了一种磁增强 SPR (M-SPR)(未发表的数据),结果表明其检测限低至 1.5 × 103个病毒颗粒mL -1,比常规SPR的检测限低两个数量级,为5.9×10 4 个病毒颗粒mL -1。这个和其他概念将允许在未来推动 SPR 领域。
可以推断,等离子方法也可能适用于 COVID 后危机,特别是为区分长期 COVID 患者和其他患者提供诊断参数。现在已经认识到,许多感染 SARS-CoV-2- 的患者会在最初感染几个月后出现急性后 COVID 综合征。这一健康阶段称为长期 COVID,发生在 30-50% 的 COVID-19 患者中,其特点是多系统症状、持续疲劳和认知障碍,随着年龄和女性性别的增加而更加普遍。尽管早期的印象是长期 COVID 只能在住院和插管的患者中发展,但越来越多的证据表明,无论原始症状的严重程度如何,长期 COVID 都可以发展 。
其他与本文内容相关的科学证据:
Biosensors (Basel). 2022 Jul; 12(7): 548.
Published online 2022 Jul 21. doi: 10.3390/bios12070548
Plasmonic Approaches for the Detection of SARS-CoV-2 Viral Particles
(责任编辑:admin)



