【佳学基因检测】如何提高肺癌靶向药物基因检测的治疗效果?
肿瘤靶向药物治疗需要基因检测
肺癌仍然是全球范围内发病率和死亡率均居首位的最常见恶性肿瘤,非小细胞肺癌(NSCLC)是肺癌的一个亚型,其临床和分子异质性广泛,可以通过肺癌靶向药物基因检测及致病基因鉴定基因解码进行分析确定。在NSCLC中,表皮生长因子受体(EGFR)突变是最常见的驱动基因,其次是RAS和ALK,这些基因是肺癌靶向药物基因检测的常见内容。只有一部分病人对靶向治疗初次反应良好,然而,大部分病人最终会产生药物耐受性。
目前,肿瘤靶向药物中的免疫检查点抑制剂(ICIs)在治疗包括NSCLC在内的许多类型的癌症中,实现了积极的实验室结果和显著的临床反应。然而,在NSCLC临床试验中,EGFR突变患者从免疫检查点抑制剂(ICIs)中获益较少,与KARS、BRAF和MET突变患者相比。肿瘤精准治疗基因解码揭示,抗原表达和呈现不足,突变负担低,免疫抑制的微环境,以及PD-L1的上调可能是免疫检查点抑制剂(ICIs)s在EGFR突变NSCLC患者中效果有限的机制。
然而,一些肿瘤携带EGFR突变的NSCLC患者确实对免疫检查点抑制剂(ICIs)有反应,肿瘤精准用药基因解码一直在关注肿瘤免疫表型或体细胞突变特征,以为这一群体开发新的和更有效的治疗方法。迄今为止,利用个体化新抗原疫苗策略对抗癌症已在小鼠模型和临床设置中取得成功。由肿瘤特异性体细胞突变产生的新抗原是T细胞的最佳靶点,并能够引发强烈的抗肿瘤免疫反应。
为了开发一种针对对免疫检查点抑制剂(ICIs)有反应的带有EGFR突变的NSCLC患者的个体化新抗原疫苗,肿瘤靶向药物基因检测的持续研究对1862份中国NSCLC肿瘤组织与正常组织样本进行了基因信息的解码解密分析,这些样本此前已经使用肿瘤基因850基因检测基因面板进行了分析。在分析过程中评估了突变等位基因的表达,并预测可能的新抗原。在肿瘤基因解码过程中,精准用药基因检测发现EGFR L858R突变可能是为带有HLA A*33:03的NSCLC患者开发个体化疫苗的好靶点。精准治疗基因检测进一步研究了EGFR突变亚型的免疫学特征(HLA LOH、B2M、TMB和TME),以收集支持EGFR L858R新抗原可行性的证据。临床应用研究结果不仅为预测对ICIs的反应提供了有用的信息,还为中国EGFR突变的NSCLC患者提供了一种有希望的治疗方法,这些患者未能通过ICIs治疗,也没有其他替代疗法。
肺癌精准用药基因检测的研究方法
HLA分型基因检测
肿瘤基因检测的研究使用OptiType v1.0进行HLA分型,获取每位患者每个位点的四位数HLA类型。基因解码研究使用等位基因频率网络数据库检索普通中国汉族人群中等位基因的等位基因频率(AF),并根据这个公式计算载体频率:载体频率 = 1-(1-AF)²。
新抗原预测和优先级设定基因检测
对于每一位患者,肿瘤精准用药研究从佳学基因的数据库中的以前的记录里也检索出人工整理的体细胞突变(错义或框内indel,AF≥0.05)在编码区。使用netMHCpan v4.0(27)预测新抗原。候选者如果IC50 mut <500 nM且IC50 wild >=500 nM则被考虑进一步分析。如果IC50 mut <500 nM,那么一个可能的新抗原就被认为是突变特异的,尤其是如果IC50 mut <50 nM,那么它被认为是“强绑定者”。
人类白细胞抗原(HLA)基因的杂合性丧失(LOH)
使用McGranahan等人开发的lohhla算法推断所有三个人类白细胞抗原(HLA)位点的LOH状态。如果计算出的p值(输出中的“PVal_unique”)<0.01,那么一个位点就被认为受LOH影响。在一个HLA位点上有LOH的患者被定义为至少有一个HLA位点受LOH影响的人。所有其他患者(包括那些在所有三个HLA位点上都有纯合等位基因的人)被认为没有受到HLA LOH的影响。
四种EGFR突变类型中的突变数量
样本被分为四个子组:带有L858R突变,带有外显子19中的缺失(19del),带有其他EGFR突变,和EGFR野生型(WT)。通过计算非同义突变的总数来量化每个样本中的突变。然后进行组间的Kruskal-Wallis检验。
TCGA中的NSCLC数据集和预处理
体细胞突变和RNA测序(RNA-seq)数据从TCGA(https://portal.gdc.cancer.gov/)下载。考虑到在495例肺鳞癌中未发现EGFR L858R突变,因此,肿瘤基因解码基因检测只从肺腺癌样本中挖掘突变数据。肺腺癌队列被划分为四个簇:EGFR L858R(n=21),EGFR 19del(n=21),EGFR其他(n=29)和EGFR WT(n=490)。获得了包含594个癌症组织样本的TCGA-LUAD(肺腺癌)FPKM数据。排除后,对具有EGFR突变状态数据的513名肺腺癌患者的数据集进行了分析:EGFR L858R(n=21),EGFR 19del(n=19),EGFR其他(n=28),EGFR WT(n=445)。
推断TME中的浸润细胞
CIBERSORT(http://cibersort.stanford.edu/)是Newman等人开发的一种分析工具。用于量化组织样本中的免疫细胞比例。佳学基因使用CIBERSORT算法和LM22基因签名,这个签名被用来区分22种免疫细胞表型,包括B细胞、T细胞、自然杀伤细胞、巨噬细胞、DCs和髓样亚群。肿瘤基因解码基因检测使用CIBERSORT来估计不同的EGFR突变亚型中22种免疫细胞类型的比例。
肺癌中基因突变情况的统计分析
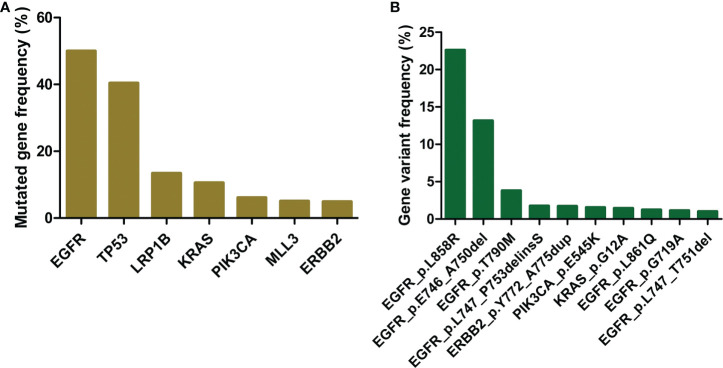
选择等位基因频率大于或等于0.05的体细胞错义或框内indel突变进行新抗原预测和预测后分析。肿瘤基因检测统计分析在所有患者中检测到超过10,000个突变(每位患者约5个)。这些突变影响了800多个基因。EGFR和TP53是突变频率最高的基因,分别在所有患者中的50%和40%中发现了突变。接下来是LRP1B和KRAS,它们分别在所有患者中的13%和11%中发生突变。当在变异水平上进行检查时,EGFR突变L858R和E746_A750del显然是主导。它们的频率分别为23%和13%,比列表上的第三个突变高出7倍和4倍。EGFR基因型结果主要与NSCLC患者中驱动突变患病率的先前研究相一致(3,4,31)。有趣的是,虽然LRP1B基因在适度比例的患者中发生突变,但LRP1B突变并未在变异水平上名列前茅(最高频率为0.11%)。尽管有上述基因和突变,但这些基因和突变的绝大多数是由少数患者携带的,通常不到人口的1%。
肺癌肿瘤基因检测研究结果及其应用
非小细胞肺癌(NSCLC)占所有肺癌的大约85%,是一种具有高突变负荷的肿瘤。尽管NSCLC携带许多已知的驱动突变,但个体之间的基因组异质性广泛。不同的分子亚型对各种治疗的敏感性不同。例如,对于治疗EGFR驱动的肺癌,EGFR TKIs一直是首选。然而,对TKIs的获得性抗性是不可避免的。作为一种具有持久反应潜力的新兴治疗方法,由于从其他分子亚群中获益较少,因此不推荐将ICIs用于EGFR驱动的肺癌患者。然而,基因检测EGFR突变是NSCLC中最常见的基因改变。有必要找到一种有效的治疗方案,以显著提高这一亚组的免疫疗法效果。
在这项肿瘤基因检测研究中,肿瘤基因解码基因检测对1862名接受了1021基因组靶向测序的中国NSCLC患者中的新抗原进行了基因信息检测及解码分析。尽管不同患者间有些相同的突变,但并非每种突变都会作为新抗原,因为其与每位患者自身HLA的结合亲和力可能会有所不同。通过结合共享频率和结合亲和力来确定肿瘤特异性的体细胞突变,肿瘤基因检测的大数据显示,EGFR L858R是最主要的新抗原产生的基因等位基因,这些新抗原大多被预测为会结合到A*33:03。接着肿瘤精准用药基因检测进一步分析了EGFR突变亚型的免疫特征,以找到支持EGFR L858R新抗原可行性的证据。
新抗原呈现和被T细胞受体识别的关键步骤是由HLA控制的。因此,需要考虑的不仅是肽与HLA的结合亲和力,还有由于HLA单倍型丢失或抗原呈现机制基因(如B2M)的突变引起的HLA表达的丧失。佳学基因等机构发现,肿瘤基因检测临床应用研究队列中63.1%的NSCLC发生了HLA LOH,这一比例高于以前的研究报道的40%,并且与EGFR突变亚型无显著关联。此外,选定的HLA(A33:03, A31:01, 和 A68:01)的HLA LOH也没有显示出任何差异。佳学基因接着检查了B2M的异常。具体来说,肿瘤的基因解码只发现B2M中有一个框架移位突变:p.L15Ffs41,并没有发现B2M的异常在任何EGFR突变亚型中被显著富集。由于B2M对于所有HLA类I复合物的装配至关重要,而HLA LOH可能有助于免疫逃避(38),肺癌靶向药物基因检测的这些否定性的发现表明,EGFR L858R可能在新抗原呈现方面没有缺陷,至少在HLA LOH和B2M突变中没有起到关键作用。
TMB通过产生新抗原增强抗原应答。因此,佳学基因采用基因检测接下来试图评估TMB的属性与EGFR突变亚型之间的关系。肿瘤精准用药基因解码基因检测的panel分析表明,与其他EGFR稀有位点突变和EGFR WT相比,EGFR L858R和EGFR 19del有最低的TMB,尽管在EGFR L858R和EGFR 19del之间没有发现差异。这与使用ICIs治疗的EGFR突变NSCLC的反应率较低一致,TMB较低被认为是EGFR L858R NSCLC免疫疗法效率低的主要原因。然而,这与其他研究的结果不同,那些研究表明EGFR 19del突变的肺癌与EGFR L858R突变的肺癌相比,TMB更低,这可能是由于种族、组织学和阶段等因素的不同。此外,肿瘤细胞嵌入在肿瘤微环境(TME)中,这表明细胞间关系与基因组因素一样重要。在肿瘤靶向药物的研究中,估计了NSCLC的22种免疫细胞类型的比例,并研究了TME与EGFR突变亚型之间的关系。佳学基因通过梳理发现EGFR L858R与CD8细胞比例较低,激活的CD4记忆T细胞比例较低,M2型巨噬细胞比例较高与EGFR WT相比。总的来说,这些揭示了EGFR L858R亚型中的抑制TME。
佳学基因肿瘤靶向药物基因检测收集了非小细胞肺癌(NSCLC)病例群体,通过使用1021基因组靶向测序探索肿瘤特异性的体细胞突变,以开发新抗原疫苗。在肿瘤的靶向药物及新的治疗靶点的分析中,发现了EGFR L858R新抗原,在HLA亚型特异性方式中被识别出,可以用来在HLA A33:03亚型的患者中制造癌症疫苗。EGFR L858R在HLA A33:03的患者中可能对2.93%的人口产生影响。考虑到肺癌是最常见的癌症,可能从中受益的患者比例相当可观。然后,肿瘤的创新疗法研究团队提出,较低的肿瘤突变负荷(TMB)和被抑制的肿瘤微环境(TME)可能是EGFR L858R亚型的非小细胞肺癌免疫原性弱的原因。在HLA LOH和B2M机制中没有缺陷,这表明EGFR L858R的抗原呈递过程在运作。
佳学基因评估了这一研究所需要进一步开展的方向。一个限制是1021基因组的测序数据与全外显子测序(WES)或全基因组测序(WGS)相比不足,并且只覆盖了所有编码区域的一部分。除了B2M外,它没有覆盖与HLA呈递有关的基因突变,这些突变已被证明是免疫检查点抑制剂(ICIs)的耐药机制,如TAP1, TAP2, LMP2和LMP7。然而,由于该面板覆盖了大部分同时发生突变的基因区域,它能够捕获必要的信息。此外,作为新抗原肽识别的不可或缺的组成部分,T细胞受体(TCR)谱系的剖析需要被探索(48)。最近对非小细胞肺癌的研究已经探讨了TCR谱系是否可以评估T细胞的多样性和T细胞的克隆扩展,并指出EGFR突变肿瘤展示了较低的T细胞克隆扩展。未来,肿瘤精准用药基因检测的升级版计划进行TCR测序以阐明是否在EGFR突变亚型中存在着TCR谱系多样性的显著差异,目标是研究EGFR L858R中TCR谱系模式的独特特征。这项研究的另一个值得改进的地方是缺乏可用的测序数据直接比较这个队列中的TME。为了解决这个问题,基因解码使用了TCGA数据源,但是这个数据源并不能代表中国队列中的真实肿瘤免疫基因组景观。最后,这是一项回顾性研究,临床信息如病期和治疗策略是不完整的。因此,无法进行分层分析以探索一些潜在的机制。
在对基因检测结果的分析中,排除了帧移位突变的分析。这样做的理由是存在产生假阳性的可能性。这样的突变通常导致早期终止密码子,这会在翻译之前通过无义介导的mRNA降解(NMD)导致转录物的降解。一个通过RNA-Seq评估NMD效率的方法已经发表,但由于缺乏RNA-Seq数据,这里不能应用。然而,估计了我们的发现有多大程度上的偏差。总共检测到975个帧移位突变(915个独特的),涵盖了670个样本。肿瘤的更新的基因检测重新计算了每个基因考虑帧移位突变的突变频率。突变频率最高的6个基因没有改变,而其他的基因进行了重新排序。对于一些基因,重新计算后的突变频率增加,如TP53和LRP1B。这表明在一些患者中,这些基因只检测到了帧移位突变。TP53突变频率从40.44%增加到48.34%,这表明这一特定的基因解码研究可能低估了其在新抗原产生中的潜在作用。然而,最常见的帧移位突变STK11 P281Rfs*6只在六个患者中共享,这转化为0.3%的百分比(补充表4)。这并不符合我们寻找共享新抗原的目的。
总的来说,这一肺癌基因解码基因检测的研究发现EGFR L858R新抗原有潜力在HLA A*33:03的非小细胞肺癌患者中生成癌症疫苗,并揭示了EGFR突变亚型之间可能的免疫特征。佳学基因的发现为进一步的研究提供了基础,哪些基于新抗原的疫苗可能成为患有EGFR L858R突变的患者的有效治疗策略。
(责任编辑:admin)


