【佳学基因检测】使用高通量基因筛选鉴定新的放射敏感性调节剂
放射疗法的基因检测导读:
电离辐射 (IR) 对人体的生物学影响不仅取决于辐射的物理特性和吸收剂量,还取决于受照射个体的独特敏感性。IR 的一个关键目标是 DNA,DNA 损伤反应是一种保护机制,用于维持基因组完整性以应对诱导的细胞应激。未修复的 DNA 损伤会导致各种突变,从而对健康产生不利影响。细胞对 IR 的敏感性与细胞修复 DNA 损伤的能力高度相关,特别是影响该过程的基因的编码序列以及有助于保持基因组完整性的其他基因的编码序列。然而,准确分析个体敏感性背后的分子事件需要具有灵敏读数的技术。在这里,我们总结了最近使用全基因组分析并确定影响个体放射敏感性的基因的研究。虽然微阵列和 RNA-seq 提供了转录组的快照,但 RNA 干扰 (RNAi) 和 CRISPR-Cas9 技术是强大的工具,可以调节基因表达和表征涉及放射敏感性或放射抗性的特定基因的功能。值得注意的是,CRISPR-Cas9 已经改变了基因组编辑技术的格局,因为它提高了准备性、精度和灵敏度。确定细胞放射敏感性的关键调节因子将有助于定制提高治疗效果和快速预测临床结果的方案。它还将有助于基于平均个人敏感性的职业保护,
放疗敏感性调节药物及制剂研究关键词
放射敏感性,放射抗性,基因组编辑,CRISPR-Cas9,电离辐射
1. 放射敏感性调节药物与制剂简介
在其一生中,人类可能会暴露于各种来源和剂量的电离辐射 (IR),无论是来自诊断检查(例如计算机断层扫描和核医学扫描)、环境和职业暴露,还是癌症和其他疾病的治疗. 无论暴露于低剂量或高剂量电离辐射(LDIR、HDIR),DNA 都是 IR 的主要细胞靶点。DNA 损伤反应是一种保护机制,可维持基因组完整性以应对各种形式的细胞应激,包括 IR。如果不加以修复,DNA 损伤,尤其是 IR 诱导的 DNA 双链断裂 (DSB),可能会导致基因组不稳定,从而导致体内稳态扰动和传播到后代细胞的有害后果。尽管已知辐射剂量和剂量率以及遗传易感性和环境因素决定了细胞反应的性质和程度,但信号通路(例如,在 DNA 修复、氧化代谢或免疫反应中)的作用仍不清楚和正在调查。识别这些途径中涉及的分子事件将揭示决定放射敏感性的关键途径中的新生物标志物。本综述总结了当前的研究结果,使用高通量筛选技术,确定正常组织和癌细胞中的关键辐射抗性或敏感性调节剂,这些调节剂可用作治疗靶点,也有助于个性化治疗策略。
2. 辐射响应
自 1895 年伦琴发现 X 射线以来,已经报道了对 IR 的各种反应。到 1906 年,患者的放射敏感性差异被认为是影响 X 射线医疗应用放射治疗结果的主要因素之一. 然而,放射敏感性的定义近年来受到了挑战。电离辐射独立咨询小组已将放射敏感性重新定义为衡量细胞或生物体反应程度的指标,而不是衡量 IR 诱导的细胞死亡的指标。此外,“抗辐射”是一个复杂的过程,其中多个基因参与了防止损伤发生或修复或消除受损细胞的各种机制。癌细胞或正常组织的诱导辐射抗性也有助于细胞适应随后的环境挑战(即IR),以及抵消氧化代谢的有害影响。
人类对 IR 的反应受各种因素的影响,例如年龄、吸烟、疾病和基因型。例如,一项针对乳腺癌患者的初步研究评估说,放疗 (RT) 引起的正常组织损伤的 81% 到 90% 的变化是由于患者的特定特征造成的。放射敏感性的这种变化部分受个体遗传或表观遗传特征的影响。虽然辐射诱导的 DNA 损伤可以有不同的形式(即碱基修饰、单链断裂和 DSB),但放射敏感性是细胞进行特异性 DNA DSB 修复的能力 。DNA DSB 修复的两个主要途径是容易出错的非同源末端连接 (NHEJ),它通过细胞周期被激活,以及同源重组修复 (HRR),它发生在 S 和 G2 后期。介导这些途径的分子事件继续被理解并为新发现提供了机会。主要在 HDIR的背景下研究了人群中 DNA 修复机制的细胞能力的个体差异。例如,突变的BRCA1/2基因携带者在正常细胞和肿瘤细胞中都具有更高的放射敏感性。此外,频繁暴露于诊断辐射可能会带来问题,尤其是对于在年长时表现出不利健康影响的年轻人而言。暴露于累积剂量的 X 射线或 CT 扫描会显着增加儿童患白血病或脑癌的风险。然而,个体放射敏感性的确切分子基础,特别是在 LDIR 中,仍然知之甚少,放射敏感性的生物标志物也难以捉摸。由于人类中有大量(超过 2 万个)基因,低通量研究可能无法有效筛选所有涉及放射敏感性的调节剂。相比之下,高通量分析提供了快速跟踪的预测测试,并在辐射暴露的情况下为高危人群定制治疗方案或公共政策。
3. 研究放射敏感性和抗性的高通量筛选方法
3.1. 基因表达分析(微阵列和 RNA 测序)
随着关键“组学”相关技术的发展,如 RNA 测序、微阵列、RNAi和 CRISPR-Cas9。高通量筛选可以识别特定表型的新基因或调节因子,并产生可以在低通量机制和功能研究中验证的新假设(图1)。
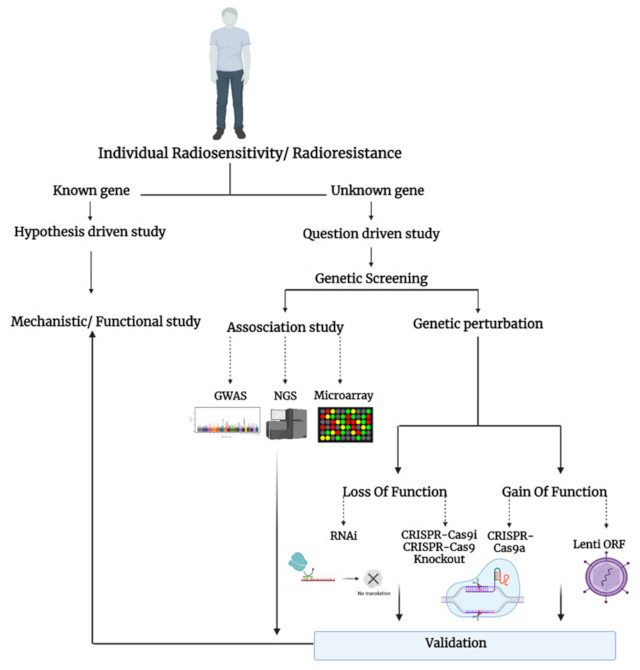
图1:个体放射敏感性研究的示意图
使用高通量基因表达方法,一些研究已经确定了影响对辐射反应的基因。例如,郭等人在肺癌细胞中使用 DNA 微阵列分析。分析响应 IR的全局基因表达。一个微阵列包含数以千计的工程互补 DNA (cDNA) 寡核苷酸,这些寡核苷酸被称为与特定荧光标记的 RNA 分子杂交的探针,并且可以同时检测到不同已知转录本的表达。郭等人他们的分析重点是 2 个肺癌细胞系(NCI-H446 细胞与 A549 细胞)中 143 个基因的表达,这些细胞系对单次 5 Gy 剂量的伽马射线具有不同的放射敏感性。与放射敏感性 NCI-H446 细胞相比,在放射抗性 A549 细胞系中,参与 DNA 修复机制的基因XRCC5、ERCC5、ERCC1、RAD9A、ERCC4和MDM2 的表达显着增加。作者认为,这个基因列表可能有助于使抗辐射肺肿瘤敏感。
执行下一代 RNA 测序 (RNA-seq),已经对整个细胞群中响应 IR 的基因表达改变进行了广泛的研究。在寻找癌细胞对 IR 反应的预测因子时,Young 等人采用 RNA-seq 方法分析放射敏感性 LNCaP 和放射抗性 PC-3 前列腺癌细胞中的基因表达。他们在高能 X 射线照射后 24 小时在两种细胞系中确定了两条具有相反反应的典型途径:DNA 修复途径(LNCaP 中BRCA1、RAD51和FANCG的下调以及 PC-3 细胞中相反的模式)和细胞周期DNA复制途径的控制(ORC1、CDC6的下调和在PC-3细胞中具有对比模式的MCM基因)。在另一项研究中,人类神经胶质瘤细胞中的整体基因表达在暴露于导致生长停滞的伽马射线剂量后进行了检测。结果表明,促凋亡信号分子的失活和抗凋亡基因的晚期激活可能有助于胶质瘤的放射抗性。深度测序用于描绘人类乳腺癌细胞对 IR 的转录反应的不同层。这项研究确定了对 IR 有反应的蛋白质编码基因和以前未识别的非编码基因。因此,RNA-seq 允许对整个转录组进行完整测序,而微阵列仅通过探针杂交分析预定义的转录本。在 RNA-seq 中,来自基因和基因变体(例如,剪接异构体)的纯化 RNA 被直接测序(无需探针的帮助)。因此,虽然微阵列和 RNA-seq 都可以显示大量差异表达的基因,但 RNA-seq 揭示了对更广泛基因表达的无偏筛选,具有更高的特异性和敏感性,包括新的、编码的和非编码的转录本。微阵列。
上一节中描述的批量 RNA-seq 分析通常测量细胞混合物中的转录物,这允许仅测量细胞群中的平均转录物表达。这种传统的测序方法无法分析稀有人群中发现的少量细胞,也会丢失细胞异质性信息。单细胞 RNA 测序 (scRNA-seq) 是一种创新的 NGS 方法,能够以单细胞分辨率测量整个转录组,并有助于了解单个细胞在其自然微环境中的转录电路的变化。在两项不同的研究中使用 scRNA-seq 方法来研究食管鳞状细胞癌细胞 (ESCC) 的获得性放射抗性。同样,使用条形码 Smart-seq2 技术对乳腺癌细胞系 MDA-MB-231 进行和不进行 IR 处理的 scRNA-seq 揭示了对 IR 诱导的 DNA 损伤的异质细胞反应。scRNA-seq 数据分析还确定了辐射敏感性的潜在生物标志物,包括参与 DNA 复制的MCM3、MCM4和SLBP基因。因此,单细胞测序技术有能力描绘不同癌症类型对 IR 的异质反应,从而改善治疗选择。
然而,尽管这些平台已经帮助识别了许多与放射敏感性有关的基因,但确切的机制仍不清楚。要了解该机制,第一步也是最重要的一步是检测人群中的确切基因组变异。知道确切位置将允许探索转录因子结合位点和受影响的调节因子。然而,当表型受多个基因(多基因模式)影响时,这是具有挑战性的,与孟德尔模型相反,孟德尔模型的疾病是由常染色体或性染色体上的单个基因突变引起的。放射敏感性是一种数量多基因性状,是细胞途径之间相互作用的产物。出于这个原因,使用全基因组关联研究 (GWAS) 是合适的,该研究已成功绘制出与疾病风险相关的复杂性状相关的数千个基因座和 DNA 序列变异。
3.2. 全基因组关联研究(GWAS)
GWAS 检查以单核苷酸突变形式呈现的变异。当这些突变的频率超过人口的 1% 时,它们被称为单核苷酸多态性 (SNP)。在 SNP 的首批临床研究之一中,Kerns 等人使用 GWAS 方法研究与勃起功能障碍相关的遗传变异,作为前列腺癌患者放射治疗 (RT) 后正常组织损伤的指标。从 512,497 个 SNP 的高通量分析中,rs2268363 位于编码产物影响雄性性腺发育和功能的基因(FSHR基因),与 RT 的长期副作用的发展密切相关。这有力地支持了使用 GWAS 方法探索正常细胞遗传易感性与辐射损伤之间关联的可行性。
此外,虽然辐射诱发的生殖系突变或受辐射父母子女的遗传性疾病仍未得到证实,但已确定人类体细胞放射敏感性性状可遗传的有力证据。为了发现影响放射敏感性的基因和 SNP,Zyla 等人使用 GWAS 方法对人类双胞胎进行基因组分析,结果表明,响应辐射的CDKN1A (细胞周期蛋白依赖性激酶抑制剂 1A)表达中约有 66% 是可遗传的。CDKN1A编码蛋白质 p21,p53 的下游效应子,是 DNA 损伤后细胞周期调节和停滞的关键调节因子之一。CDKN1A异常表达与对辐射的急性敏感性有关。此外,GWAS 允许鉴定与CDKN1A表达显着相关的 SNP(即 rs205543(ETV6基因)、rs2287505 和 rs1263612(KLF7基因)参与CDKN1A转录因子、rs6974232(RPA3基因)、rs1133833(AKIP1基因)、和 rs17362588(CCDC141基因)是参与 DNA 错配和 RNA 修复的基因(总结于表1)。
表格1:对当前抗辐射研究的摘要。
| 作者 | 方法/剂量类型 | 型号/电池类型 | 发现 |
| 王等人 |
全基因组 RNAi 筛选/ 单剂量 6 Gy,X 射线 |
在体外和小鼠模型中暴露于 X 射线的结直肠癌细胞 | RFC4 在体外和体内保护结肠直肠癌细胞免受辐射诱导的 DSB 和细胞凋亡;RFC4 增强了抗辐射性。 |
| 赫尔等人 |
全基因组 RNAi 筛选/ 单剂量 4 Gy (1.96 Gy min -1 , Cs 137 ) |
人骨骨肉瘤上皮细胞(U2OS系) |
CDC73 是 HRR 介导的 DNA 修复和基因组稳定性的重要调节因子。 CDC73 增强抗辐射性。 |
| 范哈夫滕等人 |
全基因组 RNAi 筛选/ 单剂量 60 Gy, Gammacell 1000 (Cs-137) |
C. elegans菌株:野生型 Bristol N2、NL1832 ( pk732 ) 和 TY1774 yIs2 [ xol-1 :: lacZ rol-6 (pRF4)] IV。 | 鉴定了参与对 DNA DSB 的细胞反应的基因。 |
| 范哈夫滕等人 | 全基因组 RNAi 筛选/单剂量 140 Gy a Gammacell 1000 (Cs-137) | 使用了线虫菌株:野生型 Bristol N2、atm-1 (gk186)、lig-4 (ok716) 和 cku-80 (rb964) | 共鉴定出 45 个秀丽隐杆线虫基因,这些基因增加了生殖细胞对电离辐射的敏感性。 |
| 克恩斯等人 |
GWAS/ 39 到 42 次 1.8 Gy X 射线 |
从淋巴细胞中分离的 DNA | 确定了与作为 RT 副作用的勃起功能障碍相关的 SNP 的位置。这些 SNP 仅针对具有非洲血统的患者。 |
| 齐拉等人 |
GWAS/ 单剂量 2 Gy X 射线 (0.5 Gy/min) |
血液T淋巴细胞 | 确定了影响辐射敏感性的 SNP。 |
| 韦斯纳夫等人 | GWAS/伽马射线连续暴露(4 小时 45 分钟),4.85 Gy/min,总剂量为 1382 Gy | 果蝇遗传参考小组 (DGRP) | 鉴定了与辐射抗性变化相关的新基因。 |
| 朱等人 |
整个 CRISPR-Cas9 筛选(阳性筛选) 用 X 射线辐照器以 12、15 Gy/min 的剂量率治疗三轮 |
胶质母细胞瘤细胞 | CARHSP1 增强胶质母细胞瘤癌细胞的放射抗性。 |
| 紫妍等人 |
整个 CRISPR-Cas9 筛选(阴性筛选)/ 单剂量 2 Gy |
鼻咽癌 | 鉴定了 9 个与 NPC 细胞的放射敏感性或放射抗性有关的基因。 |
| 海曼等人 |
整个 CRISPR-Cas9 筛选 (阳性筛选) |
颈部鳞状细胞癌 (HNSCC) | 在体外和体内模型中,敲除 STING 显着提高了辐射存活率。 |
| 于等人 |
整个 CRISPR-Cas9 筛选 (负筛选) 6 和 12 单剂量 X 射线;剂量率:5 Gy/min |
大肠癌细胞 | 通过抑制细胞周期调节蛋白 CDK6 的表达并促进 G1/S 期细胞周期停滞,microRNA-5197-5p (miR-5197) 被报道为放射增敏因子。 |
| 韩等人 | 整个 CRISPR-Cas9 筛选(阳性筛选) | 非小细胞肺癌细胞系 | 证明了 CRISPR 筛选中 2D 单层和 3D 球体癌症模型之间的主要差异。 |
此外,黑腹果蝇遗传参考小组 (DGRP) 是一个有价值的平台,它允许对影响特定数量性状的潜在基因、多态性或途径进行 GWAS 和作图分析。使用这个模型,Vaisnav 等人发现了九个果蝇基因(如下所列并总结于表1) 与可能参与抗辐射的人类同源物。此外,作者发现了 32 个与辐射抗性相关的 SNP(在p < 10 -5时,在p < 10 -6时有两个 SNP)。在这些新的抗辐射候选者中,九个具有人类同源物,其功能实际上不参与修复 DNA 损伤,突出了辐射抗性特征的其他机制的潜力:人类同源蛋白 ATP5J(ATP 合成),SLC 家族 35 成员 E1 (膜转运蛋白)、凝血因子 II(凝血)、E3 泛素连接酶/SMURF2(泛素化)、蛋白质 VPRBP(细胞周期、端粒酶调节和组蛋白修饰)、转录因子 GATA-4(胚胎发生、心肌分化)、肌张力障碍/大疱性类天疱疮抗原 1(细胞粘附)、LTrpC3/melastatin-2(钙信号传导和体内平衡)和 5'-核苷酸酶前体(腺苷产生)。
为了构建更精确和有效的多基因风险模型,Oh 等人使用了数百个 SNP,并开发了一种称为预处理随机森林回归的机器学习算法,即使对于小的差异风险 也能发出信号。通过将这种新方法应用于在单个机构接受放疗的 368 名前列腺癌患者的 GWAS 队列数据集,该团队能够识别假阳性 SNP 并评估每个 SNP(每个 SNP 的关键生物学功能)在诱发放射性毒性结果。然而,GWAS 方法具有 Cano-Gamez 等人已经明确讨论过的缺点。。一个主要的挫折可能是缺乏对基因组非编码区域中疾病相关基因座的作用的理解。由于它们在不同细胞类型或生理环境中基因表达调控中的作用仍不清楚,将 GWAS 研究结果转化为临床干预可能效率不高。此外,在 GWAS 或上述其他方法中找到的候选者需要进行功能验证。为了实现这一目标,RNAi 和 CRISPR-Cas9 等功能基因组学技术是分析基因功能的强大工具。
3.3. 全基因组 RNAi 筛选方法
RNA 干扰是一种强大的方法,用于对特定表型中涉及的关键调节因子和关键途径进行功能丧失遗传筛选。该方法已被用于敲除特定基因以研究癌细胞的放射敏感性。例如,Wang 等人使用全基因组 RNAi 筛选来寻找结直肠癌细胞(HCT116 和 HCT15 细胞)中的放射抗性基因。发现RFC4敲低显着减轻 X 射线诱导的 DNA 损伤修复并增强细胞凋亡。RFC4 基因编码的蛋白质通过非同源末端连接 (NHEJ) 介导的途径促进结直肠癌细胞中的细胞 DNA DSB 修复,因此 RFC4 上调与肿瘤进展相关(总结于表1)。此外,还有五个基因,包括 NCAPH(凝聚素复合物的调节亚基)、SYNE3(机械力在核包膜以及核运动和定位中的传递)、LDLRAD2(受体介导的内吞作用)、NHP2(核糖体生物发生所必需的)和端粒维持)和FICD(ATP结合活性)也被确定为潜在的候选放射抗性基因。
赫尔等人使用相同的方法找到响应 IR 的同源重组修复 (HRR) 特异性因子。由于在 HRR 过程中将使用完整的姐妹染色单体模板,因此该途径为 DSB 提供了更准确和无错误的修复(与 NHEJ 途径相比)。作者将 CDC73(一种由HRPT2抑癌基因编码的蛋白质)鉴定为 HRR 的新调节因子。通过与 H2B 和 H3 的核心组蛋白相互作用,CDC73 优化了 DSB 周围的染色质重塑,并支持 DNA 对下游修复元件和事件的可及性(总结于表1)。范哈夫滕等人将线虫秀丽隐杆线虫暴露在 60 Gy 的辐射下,并使用全基因组 RNAi 技术鉴定了保护种系免受 DNA DSB 侵害所必需的八个基因。有趣的是,这些新发现的大多数基因具有已知的人类直系同源物(即Y65B4BR.4A(人类:WWP2)、H19NO7.2a(人类:USP7、HAUSP)、Y41C4a.10(人类:TCEB2)、Y67D8C.5(人类:UREB1、LASU1)和C52D10.9(人类:SKP1A)) 预计将通过泛素化功能在蛋白质的靶向降解中发挥作用。RAD51、组蛋白、CDC25A 和 p53,都在 DSB 反应中发挥作用,受泛素化调节。这一观察结果支持了某些蛋白质通过蛋白酶体活性激活或调节 DSB 反应途径的观点(总结于表1)。敲除这些基因提高了对电离辐射的敏感性并增强了染色体不分离。在另一项研究中,van Haaften 等人通过鉴定更多基因来扩展他们的数据,这些基因是 DNA 损伤反应和 RNA 加工和运输中的活性因子,这些基因有助于提高秀丽隐杆线虫中生殖细胞的放射敏感性。此外,发现新基因在整个动物进化过程中高度保守。在与人类同源基因中,已观察到ATM、ITGA6、NIPBL、NOB1、CAND1/TIP120、WWP2和TopBP1 (总结在表1)。
尽管无论靶基因拷贝数如何,RNAi 都是通过下调 mRNA 水平的基因表达来进行全基因组筛选的强大工具,但其脱靶效应也是不可避免的。事实上,通过 RNAi 抑制基因表达可能不是有效的,这可能只会导致部分敲低。CRISPR 介导的基因编辑技术有效地解决了 RNAi 的许多这些缺点。
3.4. 全基因组 CRISPR-Cas9 筛选方法
从细菌免疫系统中采用的成簇规则间隔短回文重复序列 (CRISPR)-Cas 相关蛋白 9,称为 CRISPR-Cas9,是一项彻底改变基因组编辑和基因治疗的新技术。CRISPR-Cas9 系统包含两个生物组件:RNA 引导的 DNA 内切核酸酶 Cas9 和嵌合单引导 RNA (sgRNA)。sgRNA 加载到 Cas9 上,并通过碱基配对定向到 DNA 靶标上的 20 bp 区域。对于功能性基因编辑,目标 DNA 必须紧接在 5' NGG 序列之前(N 是任何核苷酸),称为 protospacer 相邻基序 (PAM)。Cas9 通过重定向到其目标区域在目标基因组位点诱导 DSB 来促进基因组编辑。然后细胞机制通过 NHEJ 或 HRR 途径修复 DNA DSB。
该技术已被应用于研究几种基因(例如,Hsp70、骨桥蛋白和 HIF-1/2α)作为不同细胞系中放射抗性或放射敏感性特征的关键调节因子影响。为了开发一种综合方法并研究结直肠癌 (CRC) 细胞(RKO、HCT116 和 SW620)中的放射抗性调节因子,Yu 等人在阴性选择筛选中应用基因组规模的 CRISPR sgRNA 文库来鉴定抗辐射候选基因。他们发现 DNA 聚合酶 α 2 (POLA2)、含有自由基 S-腺苷甲硫氨酸结构域 2 (RSAD2) 和 microRNA5197-5p (miR-5197) 在 IR 暴露后具有最显着的倍数变化。然而,进一步的研究表明,与其他候选基因相比,miR-5197 的过表达在更大程度上损害了放射抗性。通过抑制细胞周期调节蛋白 CDK6 的表达并促进 G1/S 期细胞周期停滞,miR-5197 有助于 IR 诱导的 CRC 细胞凋亡(总结于表1)。然而,作者强调需要用体内模型进行进一步研究来证明他们的发现。Ziyan 等人首次在鼻咽癌 (NPC) 细胞中使用全基因组 CRISPR-Cas9 sgRNA 文库,并对在阴性筛选中获得的 sgRNA 进行高通量测序。发现 9 个基因参与 NPC 细胞的放射敏感性或放射抗性。五个基因(BLN5、FAM3C、MUS81、DNAJC17 和 CALD1)被认为是放射敏感性调节剂,而四个基因(CDKN2AIP、SP1、TOMM20和SNX22)似乎是潜在的放射抗性基因(总结在表1)。此外,对 KEGG 数据库的富集分析表明,这些基因通过范可尼贫血通路和 TGF-β 信号通路导致 NPC 的放射敏感性或放射抗性。通过 CRISPR/Cas9 高通量筛选和负选择可能与 NPC 的放射抗性有关的关键基因,Shen 等人还证明了LUC7L2的过表达通过自噬过程有助于放射抗性。LUC7L2 是一种 RNA 结合蛋白,尚未得到充分研究,仅在最近几年才被表征。
海曼等人使用电离辐射处理作为正选择压力,在 HNSCC 细胞系中进行了全基因组 CRISPR-Cas9 筛选,以确定辐射敏感性的调节因子。多轮辐照后富集的 sgRNA 的阳性筛选和 NGS 表明,刺激物或干扰素基因(称为 STING,一种与内质网相关的信号分子)的激活会影响 HNSCC 细胞的辐射反应。他们进一步表明,STING 的药理学激活可增强体内电离辐射的作用,并且可能是增强 HNSCC 患者放射治疗反应的有前景的方法(总结于表1)。在一项有趣的研究中,朱等人进行了全基因组 CRISPR 激活筛选,并确定钙调节热稳定蛋白 1 (CARHSP1) 是参与人胶质母细胞瘤细胞放射抗性特征的必需元素(总结于表1)。由于其冷休克结构域,CARHSP1 具有与单链 RNA、单链 DNA 或双链 DNA 的多嘧啶区域结合的能力。因此,CARHSP1 可以与 DNA 结合并调节转录终止率,但它也具有调节 RNA 稳定性、mRNA 降解和核糖体翻译的潜力。有趣的是,CARHSP1 增强了肿瘤坏死因子-α (TNF-α) 的 mRNA 稳定性,这是一种关键的多效性细胞因子和关键的炎症分子。有了这些信息,朱等人表明升高的 CARHSP1 水平与通过 CARHSP1/TNF-α 通路信号传导的胶质母细胞瘤细胞的放射抗性相关。程等人在 A549 肺癌细胞中使用无偏见的全基因组 CRISPR/Cas9 敲除策略,并确定 plakophilin 2 (PKP2) 是肺癌细胞抗辐射的关键驱动因素。程等人首次表明甲基化 PKP2 蛋白促进 NHEJ 并增加肺癌的放射抗性。PKP2 的精氨酸甲基化由蛋白质精氨酸甲基转移酶-1 (PRMT1) 介导。因此,PRMT1 抑制也可能是使肺癌放射增敏的一种有吸引力的方法。
总而言之,这些研究表明,CRISPR/Cas 技术的应用提供了一个无偏见的全局筛选以及参与 IR 诱导反应的基因和途径的综合图谱。
4. 放疗基因组学会的讨论意见
基因表达谱描述了同时测量许多基因或整个基因组的表达。它可以通过使用两个主要平台评估 mRNA 水平来完成:微阵列和 RNA-seq。追踪在不同环境(例如,环境或压力因素)中维持的不同细胞类型中差异表达的转录物谱给出了基因型与特定表型之间关联的图谱。与仅可以评估已知基因序列的表达的微阵列相比,RNA-seq 提供了“从头”读数,其中参考基因组或感兴趣序列的先验知识不可用。然而,对于基因组具有多基因模式的表型,GWAS 放大了核苷酸变异和 SNP,以提供与复杂性状相关的 DNA 序列的精确读数。此外,强大的基因组工具(如 RNAi 和 CRISPR-Cas9)已实现对基因功能的全面分析。
RNAi 通过敲低基因的 mRNA 使基因沉默,而 CRISPR 通过靶向 DNA 序列产生基因敲除。尽管基于 RNAi 的筛选有助于破译指导细胞放射敏感性的元素,但 RNAi 的实用性受到不完善的 mRNA 敲低、混淆脱靶效应(引入噪音)的阻碍;这使得解释表型变化变得困难,并将方法限制在转录基因上。此外,RNA 的引入可能会引发免疫反应。CRISPR-Cas9 技术通过对 DNA 进行靶向修饰以实现完全基因敲除,有效地解决了许多这些限制,从而改变了基因编辑技术的格局。此外,
遗传扰动研究中的正筛选和负筛选都已用于辐射研究;但是,屏幕的目的和结果是不同的。负筛选用于寻找导致辐射抗性的基因,而正筛选用于寻找导致辐射敏感性的基因。在阴性筛选方法中,CRISPR 编辑的癌细胞接受亚致死剂量的辐射(可能杀死约 20% 的细胞)。与对照(CRISPR编辑但未用辐射处理)细胞相比,靶向参与介导辐射抗性的基因的sgRNA随着时间的推移从群体中耗尽。在积极的屏幕上,CRISPR 编辑的细胞用致命剂量的辐射处理,使得靶向参与介导辐射敏感性的基因的 sgRNAs 在群体中随着时间的推移而富集,并且可以在测序时被识别。可以同时进行阳性和阴性筛查,以分别使用特定的辐射剂量来识别放射抗性和放射敏感性的调节剂。此外,CRISPR 是一种多功能工具,不仅可以进行功能丧失筛选,还可以进行功能获得筛选。CRISPR-Cas9 的功能增益应用基于使用与转录激活剂融合的无核酸酶 Cas9 蛋白 (dCas9),能够快速有效地增加靶内源基因的表达。类似地,可以通过将 dCas9 与转录抑制因子融合来执行 CRISPR 抑制。
放射抗性和放射敏感性的全基因组研究都是在二维 (2D) 细胞培养中进行的,这与肿瘤或正常组织的微环境不同。例如,二维癌细胞培养模型缺乏肿瘤细胞的关键特征,例如氧分压、细胞间接触改变、细胞基底膜粘附和重编程代谢。尽管二维细胞培养中的功能基因组学已经产生了丰富的信息并发现了新的调节因子,但它们往往未能反映体内的关键方面。例如,在 DepMap(一个使用基因组规模的 CRISPR 筛选在数百个细胞系中发现癌症驱动因素的项目)中,前 1000 个命中中 <1% 显示出积极的生长效应。此外,即使在二维结构中维持的癌细胞中已知的肿瘤抑制基因失活,也常常导致阴性表型。因此,对在三维 (3D) 培养系统中生长的细胞进行全基因组筛选与体内肿瘤微环境非常相似,是非常可取的。韩等人研究了 3D 肺癌球体模型中的全基因组 CRISPR 筛选,发现癌细胞的敏感性不同于单层 2D 培养物的敏感性。由于 3D 球体模型更准确地概括了体内肿瘤的微环境,Han 等人在使用 CRISPR 筛选时利用了这个模型(总结在表1)。此外,利用 CRISPR-Cas9 和 3D 细胞球体培养相结合的优势,Lan 等人检测到 DYRK1A 作为胰腺癌细胞放射治疗的敏感靶标。或者,可以在与生理条件相匹配的不同氧气和代谢条件(例如缺氧或低葡萄糖)下进行全基因组筛选以鉴定必需基因。
此外,为了获得放射增敏和放射抗性基因的综合图谱,必须整合响应各种辐射剂量的遗传、转录和翻译数据集。尽管一些研究人员已经表明辐射诱导的基因表达高度依赖于单个细胞的基因型,但有证据表明,在翻译水平进行评估时,辐射诱导的基因表达与组织类型依赖性显着相关[64, 65]。 斯塔克豪斯等人生成胶质母细胞瘤 (GBM) 患者衍生异种移植物 (PDX) 模型,并应用新的生物信息学管道分析表型、转录组和全局激酶组(功能蛋白质组)概况。通过进行全外显子组测序 (WES) 和深度 RNA-seq,作者提出,放射治疗抗性等表型变化不仅在基因组水平上介导,而且主要在表观遗传、转录后和翻译后水平上介导。
此外,迄今为止进行的基因筛查研究一直在使用 HDIR 来提高放射治疗的有效性,例如,如何提高癌症组织的放射敏感性。这与人们经常暴露的对 LDIR 的放射敏感性形成对比。此外,LDIR 不具有 HDIR 所具有的选择压力,并且响应 LDIR 的确切细胞应激诱导机制和途径尚不清楚。为了在 LDIR 的背景下找到精确的报告基因(例如 DNA 修复报告基因),CRISPR-Cas9 也可以成为一种强大的工具,可以全面分析 LDIR 暴露后激活的关键分子和途径。
基因组编辑的最新进展使得能够在不破坏 DNA 的情况下编辑 SNP,为研究与特定表型或疾病相关的遗传变异开辟了新途径。例如,新一代碱基编辑器腺嘌呤碱基编辑器 (ABE) 能够在活细胞中的目标位点直接突变,而不会激活 DSB 损伤反应 。该方法优化了不需要的等位基因向纳米致病等位基因的转化,并以最小的基因毒性影响实现了表型拯救[。使用主要编辑器系统,例如主要编辑指南 (pegRNA),可以在目标位点执行任何局部突变和所需编辑(多达几十个碱基对)。使用这些方法可以避免 CRISPR 基因剪刀技术的一些缺陷,包括不受控制的编辑结果混合、p53 激活和更大的 DNA 重排,使它们在放射防护和放射敏感性研究的背景下成为安全和精确的方法。
总之,通过扩大我们对放射遗传学和细胞放射敏感性所涉及的机制的理解,我们可以识别出可以预测临床结果的基因。有了这样的预测,可以考虑对容易出现超放射敏感性的患者进行替代治疗。此外,如果在特定人群亚群中发现了相当大的风险差异,则可以提出更量身定制的保护系统来保护特定个体。
其他支持本文内容的科技文献:Int J Mol Sci . 2022 Aug 7;23(15):8774. doi: 10.3390/ijms23158774. Identification of Novel Regulators of Radiosensitivity Using High-Throughput Genetic Screening
(责任编辑:admin)


