【佳学基因检测】精神分裂症基因检测中的miRNA检测及miRNA药物
精神分裂症基因检测导读
尽管普遍认为遗传和发育因素在精神分裂症的发病机制中起关键作用,但精神分裂症的确切病因机制对于很多人来说仍然未知。在过去的几十年中,mi RNA已成为基因表达调控中必不可少的转录后调节因子。mi RNA在大脑发育和神经可塑性中的重要性已得到公认。已知 mi RNA的异常表达和功能障碍涉及包括精神分裂症在内的许多神经精神疾病的病理生理学。在精神分裂症基因检测中的miRNA检测及miRNA药物中,佳学精神系统疾病基因解码总结了精神分裂症相关的 mi RNA失调的最新发现。和在精神分裂症的发展和发病机制中的功能作用。佳学精神系统疾病基因解码还讨论了 mi RNA调节在疾病中的潜在治疗意义。
1、简介
精神分裂症是一种致残性疾病,其特征是社会行为异常、精神障碍、思维中断和认知受损等复杂症状。它影响了全球近 1% 的人口。一般认为,发育和环境因素之间的相互作用促成了这种疾病的发病机制;然而,确切的病因仍然未知。从病理生理学的角度来看,异常的神经传递,特别是多巴胺-谷氨酸传递障碍和前额叶功能障碍改变可能在精神分裂症的大多数症状中起重要作用。最近出现的证据表明,称为 microRNA (miRNA) 的小非编码 RNA 参与了该疾病的发病机制和病理过程。miRNA 是一类约 22 个核苷酸的非编码 RNA,它可以通过与靶 mRNA 互补碱基配对以转录后方式在功能上沉默基因。每个 miRNA 都可以通过细胞内基因沉默机制潜在地调节许多下游靶基因。miRNA调控网络在神经元发育和脑功能中的重要性已被广泛研究。它的潜在作用已成为了解包括精神分裂症在内的许多神经精神疾病的发病机制和发展的焦点。在精神分裂症基因检测中的miRNA检测及miRNA药物中,佳学精神系统疾病基因解码总结了 miRNA 调控的最新发展和精神分裂症的潜在功能影响,强调了最近发现的 miRNA 作为该疾病的新生物标志物和潜在治疗方法。
2. 中枢神经系统中的 miRNA 生物发生和功能
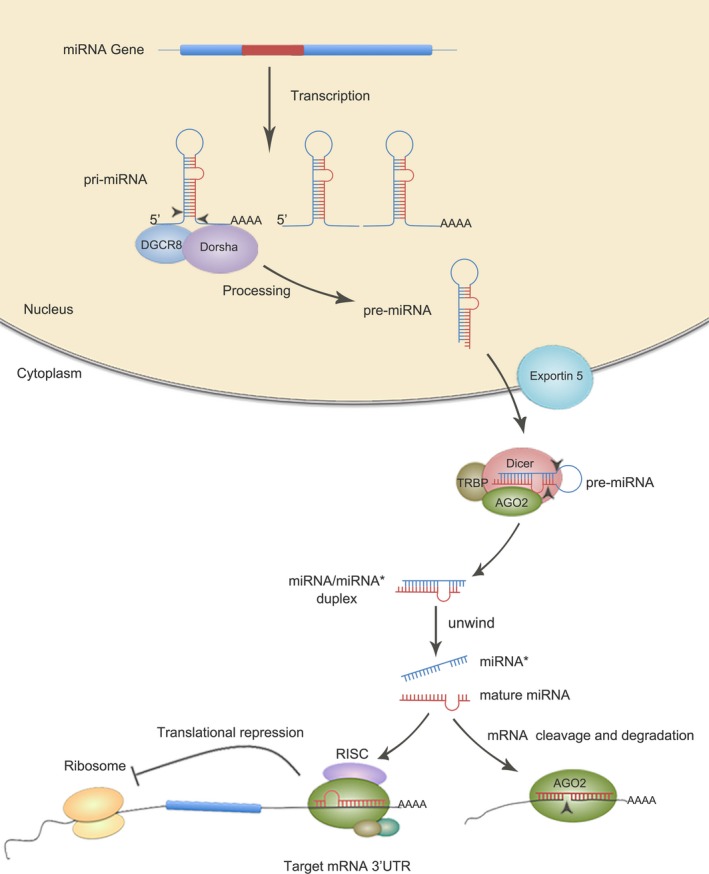
第一个 miRNA 于 1993 年在秀丽隐杆线虫中发现。第二个 miRNA let-7 花了 7 年时间才被报道。自 2000 年以来,已在动物、植物、病毒以及哺乳动物中枢神经系统中鉴定出数千种 miRNA。miRNA在细胞增殖、分化和凋亡中的功能作用已被广泛研究。miRNA 由它们自己的基因或由编码或非编码基因的内含子产生。与蛋白质编码基因一样,miRNA 被 RNA 聚合酶 II 或 RNA 聚合酶 III 从基因组 DNA 转录成初级转录物 (pri-miRNA)。pri-miRNAs通常具有一个5' CAP和一个3' poly A尾,可以在细胞核中折叠成具有茎环结构的双链RNA发夹。脊椎动物中含有 RNaseIII 核酸内切酶 Drosha 和核蛋白 DGCR8(DiGeorge 综合征关键区域 8)的微处理器复合物可以识别茎环结构。在 Drosha 切割 5' CAP 和 3' poly A 尾后,释放出 70~100 nt 发夹状的前体 miRNA(pre-miRNA)并输出到细胞质中,其中 pre-miRNA 被类型切割III 核糖核酸酶 Dicer 并产生约 22nt 双链 RNA 双链体:miRNA/miRNA* (如图 1)。在展开过程中,双链体的一条链,即成熟的 miRNA,可以加载到 RNA 诱导的沉默复合体 (RISC) 中,而另一条链通常被降解。除了 miRNA,RISC 还包含 Dicer、RNA 结合蛋白 Argonaute (AGO) 和衔接蛋白 TRBP。含有 miRNA 的 RISC 能够识别靶 mRNA 的 3'UTR 中的互补序列,从而导致靶 mRNA 的翻译抑制或降解。miRNA 与其目标 mRNA 的识别是由最初的 2-7 个 miRNA 碱基引导的。由于互补的沉默机制,一个miRNA可以靶向数百甚至数千个mRNA,而不同的miRNA也可以与同一个mRNA结合,形成一个复杂的miRNA-基因调控网络。
大约 70% 的已知 miRNA 在哺乳动物大脑中表达。Bak等人研究了成年小鼠大脑不同区域的 miRNA 表达谱。他们检测到 44 个显示组织特异性富集的 miRNA,这表明 CNS miRNA 可能与相应大脑区域内的特定功能相关。尽管成熟的 miRNA 序列在小鼠和斑马鱼之间是保守的,但超过 50% 的已鉴定小鼠富含 CNS 的 miRNA 表现出不同的表达模式。最近,Zaits 等人对 18 个年龄从婴儿期到青春期的人类供体大脑的时空 miRNA 表达进行了综合评估。使用 RNA 测序,他们报告了 miRNA 在时间(发育阶段)和空间维度(前额皮质、海马和小脑)上的表达模式。数据显示出生后不久 miRNA 表达发生了巨大变化。值得注意的是,这些 miRNA 的大多数靶基因与转录调控、神经发育过程和常见的神经发育障碍有关,突出了这些 miRNA 在脑转录网络中的中心功能。miRNA 表达的时间或大脑区域特异性方式可能暗示在大脑发育和神经元分化中的重要作用。
描述 miRNA 在中枢神经系统中作用的第一个证据来自斑马鱼的 Dicer 缺陷研究,其中发现动物无法产生成熟的 miRNA。Dicer 突变斑马鱼表现出严重的大脑发育异常和其他畸形,包括心脏。发现注入大脑丰富的 miRNA miR-430 可以挽救许多这些缺陷。在哺乳动物中,Dicer 突变小鼠在胚胎发育前 7.5 天死亡。条件性敲除皮质和海马中的 Dicer 会导致小头畸形的表型、树突分支细化和树突棘长度的改变。从那时起,有大量报道揭示了各种 miRNA 在神经元发育和分化中的作用。miRNA 在神经发生、神经保护、存活和神经精神障碍发病机制中的重要功能作用也得到了广泛的研究和综述。此外,据报道 miRNA 的改变与许多神经精神疾病有关。例如,小脑浦肯野神经元中的选择性 Dicer 消耗会导致神经退行性变化,这是一种类似于进行性神经退行性疾病(如阿尔茨海默病和帕金森病)的病理过程。更具体地说,中脑多巴胺能神经元中 Dicer 的失活导致进行性神经元死亡。这种表型通过转染从胚胎小鼠中脑获得的 miRNA 得到显着挽救,这表明 miRNA 在中脑多巴胺神经元分化和存活中起重要作用。还有其他报道描述了 miRNA 对多巴胺能神经元的各种作用。佳学精神系统疾病基因解码小组还报道了 miR-let-7c-5p 和 miR-3473b 通过调节小胶质细胞活化在缺血性脑损伤保护作用中的关键作用。鉴于 miRNA 在脑功能调节中的重要性,miRNA 的失调可能导致许多神经精神疾病的发病机制和病理过程也就不足为奇了。在这里,佳学精神系统疾病基因解码将进一步讨论 miRNA 在精神分裂症中的作用。
3. 精神分裂症中 miRNAs的失调
3.1精神分裂症中 miRNA 表达的改变
许多研究使用死后脑样本分析了 miRNA 表达谱。Perkins 等人通过定制的微阵列(miRBase 7.0 版)检查了 13 名精神分裂症患者死后前额叶皮层 (PFC) 中的 miRNA 谱。与 21 名精神疾病未受影响的个体相比,他们发现 15 种 miRNA 存在差异表达,其中 14 种 miRNA 在精神分裂症患者中下调,1 种 miRNA(miR-106b)上调。据报道,在颞上回 (STG) 的皮质灰质中 miR-181b 显着上调,STG 是与精神分裂症产生幻听有关的大脑区域。鉴定了 miR-181b 的两个靶基因,钙传感器基因 visinin-like 1 (VSNL1) 和离子型谷氨酸受体亚基 (GRIA2)。同一组进一步观察到,在 STG 和背外侧前额叶皮层 (DLPFC) 的死后组织中,与精神分裂症相关的整体 miRNA 表达显着增加。这种 miRNA 的表达升高被认为是由于初级 miRNA 加工的升高和微处理器组件 DGCR8 的上调。然而,Berveridge 的研究数据与 Perkin 的报告不一致。在 Perkins 的研究中,一些 miRNA,如 miR-26b、miR-29c 和 miR-195 据报道下调,但在 Berveridge 的结果中发现上调。关于精神分裂症中 miRNA 表达变化的报道不断积累。然而,miRNA 表达谱的结果有些争议。miRNA 表达数据的差异可能是由于样本量、治疗方案、性别因素和技术应用的差异,例如不同的 miRNA 提取方法和 miRBase 测试版本。此外,人脑中 miRNA 的时间表达模式也可能导致冲突结果。
为了探索 miRNA 作为生物标志物的潜在作用,几项研究集中在精神分裂症患者的外周血 miRNA 表达上。Gardiner 等人检测了 112 名精神分裂症患者和 76 名对照者外周血单个核细胞 (PBMC) 中的 miRNA 表达。他们发现精神分裂症患者的 83 种 miRNA 显着减少。70赖等人71还对精神分裂症患者和对照组的单核白细胞中的全基因组 miRNA 表达谱进行了分析。与阴性症状和认知能力相关的七种 miRNA(上调:miR-34a、miR-449a、miR-564、miR-548d、miR-572 miR-652;下调:miR-432)被确定为精神分裂症的预测性生物标志物。有趣的是,他们发现 PBMC 中 7 种 miRNA 的表达不受住院 2 个月的影响,即使临床症状有显着改善。还应注意的是,血液中 hsa-miR-34a 和 hsa-miR-548d 的表达改变并未出现在脑样本中。魏等人还筛选了更大样本中的血浆 miRNA 谱,并确定了 8 种差异表达的 miRNA(miR-122、miR-130a、miR-130b、miR-193a-3p、miR-193b、miR-502-3p、miR-652、miR ‐886‐5p)在精神分裂症患者中。他们还发现,患者血浆中增加的 miR-130b 和 miR-193a-3p 水平在用阿立哌唑和利培酮治疗 1 年后消失,并提出了作为精神分裂症预后生物标志物的潜在作用。此外,Gallego 等人比较了精神分裂症患者和健康对照者的脑脊液 (CSF) 和全血之间的 miRNA 表达谱。然而,脑脊液和血液中的 miRNA 表达水平相关性较差。尽管已经提出了精神分裂症患者中 miRNA 的潜在生物标志物,但显然还需要更多的研究。事实上,血清 miRNAs 测量为精神分裂症的临床诊断和预后提供了一种可行的方法,包括治疗反应。
3.2. 精神分裂症中 miRNA 生物发生的失调
miRNA生物发生和加工途径的异常被认为与精神分裂症的病理过程有关。22q11.2 缺失小鼠的产生是将精神分裂症与失调的 miRNA 生物发生相关联的最有力证据之一。人类 22q11.2 基因座的微缺失导致行为和认知缺陷,以及精神分裂症的高风险。Stark 等人产生了一种携带与人类 22q11.2 微缺失相对应的半合子染色体缺陷的小鼠品系(Df(16)A++/- 小鼠),并观察到小鼠的精神分裂症样行为。他们报道了大脑中 miRNA 生物发生的改变,并发现失调的生物发生是由于 Dgcr8 基因的单倍体不足,这导致精神分裂症的异常行为和神经元缺陷。在进一步的研究中,同一组发现位于 22q11.2 基因座内的 Df(16)A++/- 小鼠中 miR-185 急剧减少。海马和 PFC 中 miR-185 的减少(~70%-80%)超过了半合子缺失(~50%)的预期,并导致了树突和脊柱发育的缺陷。miR-185 被证明可以抑制以前未知的抑制剂 Mirta22(22q11.2 微缺失的 miRNA 靶标),该抑制剂位于高尔基体中,在产前大脑中具有较高的表达。Df(16)A(+/-) 小鼠大脑中 miR-185 表达的降低导致出生后 Mirta22 的持续抑制,并导致海马和认知功能的结构改变。斯科菲尔德等人检查了 Dgcr8+/- 小鼠,发现 Dgcr8 和 miRNA 的表达降低在锥体神经元成熟期间出现在出生后发育过程中,而不是在新生小鼠中。在 Dgcr8+/- 小鼠的 V 层锥体神经元中观察到电生理特性改变、基底树突复杂性降低和兴奋性突触传递减少。 Earls 等人报道了 Dgcr8+/- 小鼠海马中长期增强的年龄依赖性增加。这种增加归因于两种 miRNA(miR-25 和 miR-185)的丢失,它们靶向 sarco(内)质网 Ca2+ ATP 酶(SERCA2)。在精神分裂症患者的PFC和海马的死后样本中发现SERCA2的表达升高。在 22q11 缺失综合征患者的外周白细胞中也证实了 Dgcr8 和 miR-185 的表达降低。这些发现表明 miRNA 与精神分裂症之间存在致病关联。
Dicer 是 miRNA 加工途径中的另一个关键基因。斑马鱼和小鼠中 Dicer 的缺失显示出大脑发育的严重缺陷。一项用于寻找精神分裂症拷贝数变异 (CNV) 的全基因组扫描在一个个体中发现了包含 DICER1 基因的从头重复。在对中国人群的病例对照分析中,据报道 DICER 中的 SNP (rs3742330) 与精神分裂症风险高度相关。对精神分裂症患者 DLPFC 死后脑组织的分析揭示了 Dicer 表达的上调以及 miRNA 表达的整体增加。Beveridge 等报道全球 miRNA 表达在早年处于最高水平,在青春期后显着下降。Dicer 和 Exportin-5 也具有年龄依赖性,但与整个生命周期的 miRNA 表达无关。他们提出,在精神分裂症中,与神经发育相关的 miRNA 在青春期后保持在高水平,而不是在正常受试者中下降到较低水平。高水平的 miRNA 表达可能导致不适当的基因沉默,从而导致精神分裂症的异常行为。支持,Konopka 等人发现他莫昔芬诱导的 Dicer1 基因缺失成年小鼠的学习和记忆力增强。然而,当使用敲除小鼠模型时,应考虑一些因素,正如 Rajman 所指出的那样。事实上,Dicer1 已被证明对细胞存活和胚胎发育至关重要。Dicer1基因缺失通常与大量细胞凋亡和发育异常相关,这可能使表型和与精神分裂症的相关性复杂化。另一方面,并非所有的 miRNA 都依赖于 Dicer。一些 miRNA 是通过多种不依赖 Drosha 和不依赖 Dicer 的机制产生的。因此,在 Dicer1 缺陷小鼠中观察到的某些表型可能与 miRNA 的丢失没有直接关系,并且在这些 Dicer1 敲除模型中可能会遗漏一些功能性 miRNA。应该记住,miRNA 网络是一个复杂的调节系统,应该谨慎解释特定 miRNA 在 Dicer 敲除模型中表型下的功能作用。在这方面,miRNA 家族或簇可能有助于提供更容易解释的信息。7
3.3. 精神分裂症中miRNA相关的单核苷酸多态性
单核苷酸多态性 (SNP) 或拷贝数变异 (CNV) 是群体内常见的 DNA 序列变异,在非编码区更频繁地发生并导致人类疾病易感性。使用病例对照研究,已经报道了与精神分裂症相关的 miRNA 基因的几个 SNP。在斯堪的纳维亚(丹麦和挪威)样本中,miR-206 中的 SNP rs17578796 与精神分裂症显着相关。位于 pre-mir-30e 的变异 ss178077483 与汉族人群的精神分裂症密切相关(等位基因P = 0.00017;基因型P = 0.00015)。渡边等人在日本人群中复制了这种关联。精神分裂症患者外周白细胞中成熟 miR-30e 的表达水平显着升高,与精神分裂症个体 PFC 中表达增加一致。同样在中国样本中,来自 268 名患者和 232 名对照者的两个 SNP(hsa-pre-mir-146a rs2910164 G>C 和 hsa-mir-499 rs3746444 T>C)被基因分型为精神分裂症易感性。携带 rs3746444 CC 基因型的患者更容易出现幻觉和缺乏动力。然而,这两个 SNP 与精神分裂症之间没有统计学上的显着关联。在 SNP rs7289941 中也观察到负相关。最近,Yu 等人对 4384 个病例和 5770 个对照进行了精神分裂症的两阶段 GWAS,随后在另外 4339 个精神分裂症病例和 7043 个汉族血统的对照中独立复制了 13 个单核苷酸多态性。他们证实了三个位点,在 2p16.1(rs1051061,在 VRK2 的外显子中)、6p22.1(在 GABBR1 的内含子中的 rs115070292)和 10q24.32(在 AS3MT 的内含子中的 rs10883795;在 ARL3 的内含子中的 rs10883765 ),与精神分裂症显着相关。已知这三个基因座参与 GABA 能和多巴胺能信号传导、细胞粘附分子和髓鞘形成途径的调节。
发夹结构指导正确的 miRNA 加工,mRNA 的 3'UTR 影响 miRNA/mRNA 相互作用。这些区域的 SNP 可能会增加疾病的风险。筛选俄罗斯人群精神分裂症易感基因座 (22q11) 的突变发现了 miR-130b 基因区域 5'-上游的多态性,其中包含推定转录因子的 DNA 元件。然而,遗传分析并未显示 miR-130b 变异与精神分裂症的统计学显着关联。Liu 等人应用了 MiRSNP 数据库(http://cmbi.bjmu.edu.cn/mirsnp),一组人类 SNP 在预测的 miRNA-mRNA 结合位点与精神分裂症的 GWAS 结合,并确定了 7 个与 miRNA 相关的 SNP。在另一项研究中,对来自 425 个精神分裂症相关基因的 3'UTR 的 803 个 SNP 进行了计算机分析 miRNA 结合的吉布斯自由能。据报道,一种未知的 SNP(GABRA6 的 rs3219151)与精神分裂症风险的降低显着相关。另一个 SNP rs10759 (RGS4) 干扰了 miR-124 与 RGS4 的结合,因此可能增加精神分裂症的风险。大多数 SNP 分析是在中国汉族人群中进行的。约翰等人在大量遗传不同的北印度队列(1017 例病例和 1073 例对照)中,研究了候选基因中的 MiRSNP 与精神分裂症的关联。他们报告说,五个 SNP 与迟发性运动障碍有关,十二个 SNP 与强精神分裂症基因有关。最近,一项针对加拿大患者的全基因组调查显示,通过排除 22q11.2 CNV,与 miRNA 重叠的罕见 CNV 富集,而 22q11.2 CNV 已知对精神分裂症具有高度易感性。预测的 25 个 CNV 重叠 miRNA 的靶基因倾向于参与神经发育过程。这些研究表明,通过靶向精神分裂症风险基因的 miRNA 可能导致这种复杂的神经精神疾病。
最近,miR-137初级转录本内含子内的多态性(rs1625579)引起了广泛关注,发现其与精神分裂症的GWAS显着相关(P = 1.6 × 10 -11)。几项研究在苏格兰、 加拿大、澳大利亚、和中国汉族人群中复制了 miR-137 多态性与精神分裂症样本之间的相关性。然而,在一些病例对照研究中也报告了负相关结果。在精神分裂症 Psychiatric GWAS Consortium 的研究中,4 个推定的靶基因(CSMD1、C10orf26、CACNA1C 和 TCF4)也被报道与精神分裂症具有全基因组显着相关性。荧光素酶报告测定证实了 miR-137 与这四个靶基因之间的相互作用, ZNF804A 和 CALN1发现了112 个相似的结果。利用生物信息学资源,揭示了几个靶基因,包括 ERBB4、GABRA1、GRIN2A、GRM5、GSK3B、NRG2 和 HTR2C。这些基因被确定与突触长时程增强有关,这一过程可能强调精神分裂症患者的学习和记忆机制受损。使用功能性磁共振成像扫描,van Erp 等人报道 rs1627759 TT(miR-137 基因座)与 DLPFC 过度活跃有关,这是衡量大脑效率低下的常见指标。Guella 等人报道了 rs1625579 基因型与 miR-137 表达之间的关系他们观察到,与对照组中的 TG 和 GG 受试者相比,纯合 TT 受试者的 miR-137 表达水平较低。TT 受试者中 miR-137 水平降低对应于 miR-137 靶基因 TCF4 水平升高。在 SH-SY5Y 多巴胺能细胞系中,Strazisar 等人还证明表达 miR-137 变体导致成熟 miR-137 表达减少,并导致参与突触发生和神经元传递的基因组失调。然而,Siegert 等人在携带变异等位基因时观察到 miR-137 的功能增益。他们发现 miR-137 的表达增加会导致突触前靶基因如 complexin-1 (Cplx1)、Nsf 和 synaptotagmin-1 (Syt1) 的下调,并导致囊泡释放受损。在体内,miR-137 功能的增加导致突触小泡池分布的变化,苔藓纤维长时程增强的诱导受损,并导致海马依赖性学习和记忆的缺陷。所有这些观察表明,改变的 miR-137 可能在精神分裂症的病理生理学中起关键作用。
3.4. 精神分裂症中的miRNA与突触可塑性
精神分裂症被认为是一种复杂的神经发育疾病。大量证据表明,几种神经递质系统(如多巴胺和谷氨酸)的功能障碍组装了精神分裂症的病理生理过程。N-甲基-D-天冬氨酸-谷氨酸 (NMDA) 受体是突触可塑性的重要调节因子。NMDA 受体信号传导功能减退可以改变皮层回路中兴奋和抑制的平衡,并产生类似于精神分裂症症状的行为。Kocerha 等人使用 NMDA 受体拮抗剂地佐西平,可以快速诱导精神分裂症样行为,检测了小鼠不同脑区的 miRNA 表达。他们发现,用急性而非慢性地佐西平治疗的小鼠在 PFC 中表现出脑特异性 miRNA miR-219 的显着降低。在亚型 GRN1 (NR1) 突变小鼠中也观察到 miR-219 表达降低。用抗精神病药物(氟哌啶醇和氯氮平)预处理可以防止地佐西平诱导的 miR-219 减少。miR-219 的一个靶点被确定为钙/钙调蛋白依赖性蛋白激酶 II γ 亚基 (CaMKIIγ),它是 NMDA 谷氨酸受体信号级联的一个组成部分。抑制小鼠大脑中的 miR-219 可减少地佐西平诱导的行为反应,如过度运动和刻板印象,作为支持,据报道 miR-219 在患有精神分裂症的死后脑组织的 DLPFC 中显着上调。此外,发现 miR-129 参与调节少突胶质细胞分化和髓鞘维持,表明 miR-219 在突触结构和疾病相关功能中的重要性。Zhang 等人在一项病例对照研究中对 hsa-pri-miR-219/132/107 中的 3 个 SNP 和 NMDAR 信号通路基因(GRIN2A/2B/3A 和 CAMK2G)的 3'UTR 中的 6 个 SNP 进行了关联分析。 1041 名精神分裂症患者和 953 名健康对照者,证实 GRIN2B rs890 与精神分裂症显着相关。
脑源性神经营养因子(BDNF)是中枢神经系统中最普遍的生长因子,在大脑发育和神经元可塑性中起着至关重要的作用。越来越多的证据表明,BDNF 的失调与多种神经精神疾病有关。尸检研究显示,精神分裂症患者某些脑区的 BDNF 表达水平发生了改变。梅利奥斯等人发现两种miRNA,miR-30a和miR-195直接靶向BDNF 3'UTR并抑制BDNF表达。他们进一步报道了 miR-195 与 BDNF 的相互作用可以随后调节精神分裂症相关的 γ-氨基丁酸 (GABA),即 GABAergic 基因表达,包括神经肽 Y (NPY) 和生长抑素。miR-30a-5p 也被证明通过调节 BDNF 信号通路来控制酒精摄入。
认知障碍是精神分裂症的严重症状之一。对 242 个突触前蛋白和 304 个突触后蛋白的 3'UTR 分析表明,这些蛋白中有 91% 是预测的 miRNA 靶标。miR-132 在学习和记忆中的功能作用被认为与其对突触可塑性的调节作用有关。发现一些与学习和记忆相关的行为任务可以快速诱导 miR-132 表达。体内敲除 miR-132 会损害微量恐惧调节范式中的记忆获取,而转基因小鼠模型中 miR-132 的过表达显示神经元脊柱密度增加和新物体识别的改善。有趣的是,Hansen 小组报告说,miR-132 的轻度上调增强了小鼠的空间学习能力。然而,miR-132 表达增加超过三倍会损害学习。138双敲除 miR-132/212 损害了空间记忆、识别记忆和新物体识别测试中的长期增强和认知功能,表明 miR-132/212 在突触功能中的重要作用。比较 miR-132 和 miR-212 过表达小鼠和 miR-132/-212 双敲除小鼠的海马转录谱,RNA 测序结果显示 miR-132/-212 缺失小鼠中 1138 个基因的表达增加。其中 96 个基因在过表达 miR-132 的小鼠中被下调。在过表达 miR-212 小鼠中减少的 58 个基因中,只有 4 个在双敲除系中增加。尽管 miR-132 和 miR-212 共享一个种子序列,但这两个 miRNA 对于 mRNA 靶向基因并没有很大重叠,这表明转录谱调控的复杂、非冗余方式。
神经胶质细胞在大脑功能中起着至关重要的作用。已知改变的神经胶质功能涉及许多神经精神疾病的病理生理过程,包括精神分裂症。先前关于精神分裂症中 miRNA 的研究主要集中在神经元功能上,而神经胶质 miRNA 如何促进发病机制和发育在很大程度上是未知的。佳学精神系统疾病基因解码最近使用 GFAP-GFP 转基因小鼠来分析星形胶质细胞中的 miRNA,以响应急性苯环利定 (PCP) 给药。与生理盐水组相比,用 PCP 治疗的小鼠表现出 miRNA 表达改变(miR-143-3p、miR-212、miR-127-3p、miR-183、miR-298、miR-381-3p、miR-338- PFC 星形胶质细胞中的 3p、miR-let-7d-3p、miR-132-3p 等)(见表 1)。在进一步的研究中,佳学精神系统疾病基因解码探索了 miRNA 在精神分裂症中的功能作用,并发现了 miR-143-3p 失调与 PCP 诱导的小鼠行为缺陷之间的相关性(T. Cao、P. Wang、C. Lu 和 X.Zhen,未发表数据)。
表1:小鼠前额叶皮层 (PFC) 星形胶质细胞对急性苯环利定 (PCP) 治疗的反应的 MicroRNA 测序分析
| 成熟的 miRNA> | pre-ACC | 成熟序列 | PCP 与对照倍数变化 |
|---|---|---|---|
| PCP 与对照 2.0 倍变化 上调 miRNA | |||
| mmu-miR-212-5p | MI0000696 | ACCUUGGCUCUAGACUGCUUACU | 4.06 |
| mmu-miR-127-3p | MI0000154 | UCGGAUCCGUCUGAGCUUGGCU | 2.90 |
| mmu-miR-183-5p | MI0000225 | UAUGGCACUGGUAGAAUUCACU | 2.48 |
| mmu-miR-298-5p | MI0000398 | GGCAGAGGAGGGCUGUUCUUCCC | 2.46 |
| mmu-miR-381-3p | MI0000798 | UAUACAAGGGCAAGCUCUCUGU | 2.42 |
| mmu-miR-338-3p | MI0000619 | UCCAGCAUCAGUGAUUUUUGUUG | 2.40 |
| mmu-let-7d-3p | MI0000405 | CUUACGACCUGCUGCCUUUCU | 2.38 |
| mmu-miR-132-3p | MI0000158 | UAACAUGCUACAGCCAUGGUCG | 2.22 |
| mmu-miR-130a-3p | MI0000156 | CAGUGCAAUGUUAAAAGGGCAU | 2.19 |
| mmu-miR-744-5p | MI0004124 | UGCGGGGCUAGGGCUAACAGCA | 2.17 |
| mmu-miR-330-5p | MI0000607 | UCUCUGGGCCUGUGGUCUUAGGC | 2.13 |
| mmu-miR-335-3p | MI0000817 | UUUUUCAUUAUUGCUCCUGACC | 2.06 |
| mmu-miR-29c-3p | MI0000577 | UAGCACCAUUUGAAAUCGGUUA | 2.04 |
| mmu-miR-181a-1-3p | MI0000697 | ACCAUCGACCGUUGAUUGUACC | 2.04 |
| mmu-miR-872-5p | MI0005549 | AAGGUUACUUGUUAGUUCAGG | 2.00 |
| PCP 与对照 2.0 倍变化 下调的 miRNA | |||
| mmu-miR-143-3p | MI0000257 | UGAGAUGAAGCACUGUAGCUC | 0.26 |
| mmu-miR-15a-5p | MI0000564 | UAGCAGCACAUAAUGGUUUGUG | 0.45 |
| mmu-miR-1968-5p | MI0009965 | UGCAGCUGUUAAGGAUGGUGGACU | 0.50 |
| mmu-miR-582-3p | MI0006127 | UAACCUGUUGAACAACUGAAC | 0.50 |
在皮下注射 PCP (4 mg/kg) 或生理盐水作为对照后 30 分钟迅速取出 GFAP-GFP 转基因小鼠大脑。GFP阳性星形胶质细胞通过流式细胞仪从前额叶皮层分选。从分选的星形胶质细胞中提取 RNA 并用于制备 miRNA 测序文库。文库在 Illumina 流通池上捕获,原位扩增为簇,最后按照制造商的说明在 Illumina HiSeq 上测序 36 个循环。修剪后的读数与 miRBase pre-miRNA 对齐。将 miRNA 读取计数标准化为每百万 miRNA 比对的标签计数。表中显示了差异表达的 miRNA(PCP 与对照 > 2.0 倍变化)。
4. miRNA 疗法的观点
预计 miRNA 可调节 20%-30% 的人类基因。miRNA 参与精神疾病的许多方面使其成为潜在的候选生物标志物或临床诊断和治疗的靶标。尽管 miRNA 在脑功能中的重要性已得到充分证明,但仍需要更多的努力来了解 miRNA 调节机制的全部范围及其在神经精神疾病中的病理作用。仍然存在的第一个挑战是识别位于与精神分裂症相关的人类基因组中的功能性 miRNA。旨在绘制人类基因组中所有功能元件图谱的 DNA 元素百科全书项目 (ENCODE) 等项目取得了很大进展。 RNA 微阵列方法和新一代测序 (NGS) 等新型高通量技术为分析疾病中的 miRNA 转录谱及其靶基因提供了强大的工具。 miRNA 通过种子区域(miRNA 的 2-7 核苷酸)与靶 mRNA 3'UTR 的碱基对相互作用来调节靶基因。这种长度的序列将在整个基因组中以非常高的频率出现;因此,功能性 miRNA 靶位点的预测具有挑战性,但将是一项关键任务。目前,最全面、应用最广泛的预测程序是 TargetScan 和 PicTar。然而,他们预测的目标中有三分之二似乎对 miRNA 没有反应。因此,肯定需要开发或继续改进实验工具以了解 miRNA 对靶基因的影响。
鉴于许多精神疾病中 miRNA 的异常表达,抑制或过表达 miRNA 可能是临床治疗的潜在方法。已经付出了很多努力来开发高效且无毒的寡核苷酸模拟物或反义寡核苷酸以调节miRNA表达水平。与这些努力相关的是,许多化学修饰如 2'-O-甲氧基乙基和锁核酸 (LNA) 被开发出来以增强 RNA 的稳定性。在非洲绿猴的肝脏中全身递送 LNA-antimiR-212 会导致血浆总胆固醇的长期和可逆性降低,而没有任何 LNA 相关毒性的证据。用 LNA-antimiR-212 (SPC3649) 治疗感染丙型肝炎病毒 (HCV) 的黑猩猩也能长期抑制 HCV 病毒血症,没有证据表明动物对病毒产生耐药性或副作用。首次人体研究测试了一种基于 miR-16 的 miRNA 模拟物,该模拟物包装在针对恶性胸膜间皮瘤患者的 EGFR 的 TargomiRs-EDV 中。结果表明,Targomirs 在剂量为 5 × 10 9每周使用完全地塞米松预防,耐受性良好,并伴有抗肿瘤活性的早期迹象。这是一项开放标签研究,需要一项更大人群的随机 2 期研究来确认观察结果。
在探索神经疗法的此类疗法时,主要障碍是 CNS 中的血脑屏障 (BBB)。已经开发了几种将药物输送到 CNS 的方法,以通过修饰药物本身或将其与载体偶联来增强治疗分子穿过 BBB 的能力。用作纳米递送系统的外泌体介质作为递送载体具有多种优势。外泌体是最小的膜泡,形状均一,由多种哺乳动物细胞分泌。由于低免疫原性、显着的递送特性和穿过 BBB 的能力,外泌体被认为是 RNA 治疗的有效递送介质。外泌体是否可用于将 miRNA 递送至中枢神经系统仍有待测试。Hwang 等人开发了一种大脑特异性纳米载体 RVG-SSPEI(狂犬病病毒糖蛋白-二硫键连接的聚乙烯亚胺),可成功地将 miR-124a 递送至小鼠大脑。其他方法,如病毒传递系统、化学修饰和结合策略、适配体和纳米技术也已经过研究。尽管技术创新很有前景,但选择性递送到 CNS 仍然具有挑战性。同时,这些系统中传递的 miRNAs 的功能活动难以评估。在临床实践中建立真正实用的miRNA治疗方法还有很长的路要走。
五、精神分裂症基因检测中miRNA基因检测的分析结论
探索 miRNA 在 CNS 中的生物发生和功能表明 miRNA 在精神分裂症的病理生理学中起重要作用。精神分裂症患者中 miRNA 变化的精确概况及其与预后和治疗反应的关系仍然很大程度上未知。未来的工作应侧重于识别特定疾病相关的 miRNA,并了解其在调节生物学途径和病理过程中的作用的确切机制。随着技术的进步,将miRNA靶向递送至CNS可能为精神分裂症等精神疾病的治疗提供一种潜在的新型治疗方法。
Dysregulation of miRNA and its potential therapeutic application in schizophrenia
(责任编辑:admin)



