【佳学基因检测】原发性高草酸尿症基因检测
遗传病、罕见病基因检测导读:
原发性高草酸尿症 (PH) 是一种罕见的常染色体隐性遗传病,其特征是草酸盐在肾脏和其他器官中积累。根据《泌尿科基因检测的科学依据》,原发性高草酸尿症的发生与部分基因突变的关系已经明确:A**T (原发性高草酸尿症1型(PH1))、G***R (原发性高草酸尿症2型(PH2)) 和H**A1 (PH3)。在这里,佳学基因检测比较所收集的记录中原发性高草酸尿症355名患者的基因型和表型,并使用全外显子组基因测序基因检测数据计算了患病率。原发性高草酸尿症1型(PH1)(68.4% 的家庭)是最严重的原发性高草酸尿症类型,而 PH3(11.0% 的家庭)肾功能下降最慢但症状最早。一组疾病进展与 原发性高草酸尿症3型(PH3)相似但未检测到突变的患者(11.3% 的家庭)表明存在更多的基因序列变化。佳学基因确认A**Tp.G170R 错误定位等位基因导致较温和的 原发性高草酸尿症1型(PH1) 表型;然而,其他潜在的A**T错误定位等位基因会导致更严重(完全外显)的疾病。佳学基因确定了一位患有 ESRD 的 原发性高草酸尿症3型(PH3)患者;体内存在纯合的新错义突变。人口分析表明原发性高草酸尿症比临床队列确定的更常见(患病率,大约 1:58,000;携带者频率,大约 1:70)。佳学基因检测估计原发性高草酸尿症在非裔美国人中的流行率大约是欧裔美国人的三倍,因为常见的欧洲起源等位基因数量有限。预测 原发性高草酸尿症3型(PH3)与 原发性高草酸尿症1型(PH1) 一样普遍,是 原发性高草酸尿症2型(PH2) 的两倍,表明 PH3(和 原发性高草酸尿症2型(PH2))病例诊断不足和/或不完全渗透。
发性高草酸尿症基因检测关键词
传性肾病,肾结石,分子遗传学,原发性高草酸症,尿结石
原发性高草酸尿症 (PHs) 是罕见的常染色体隐性先天性肝乙醛酸代谢缺陷,其特征是草酸盐过量产生和排泄增加。草酸钙过饱和会导致复发性尿路结石和/或肾钙质沉着症,由于肾损伤导致所有组织中的草酸盐沉积(全身性草酸盐沉积),肾脏清除功能减少。
估计的原发性高草酸尿症患病率 <3:1,000,000,但在大约 20%–50% 的病例中,会在就诊前发生严重肾功能不全或移植后疾病复发。由于原发性高草酸尿症的表型异质性,从婴儿肾钙质沉着症伴肾功能衰竭到仅偶尔形成结石(类似于特发性结石病),以及对这种罕见的单基因疾病不熟悉,可能会出现诊断不足。在《肾脏疾病的临床表现及其基因检测》中,原发性高草酸尿症有三种遗传:原发性高草酸尿症1型(PH1)–3,分别与A**T 、 G***R和H**A1的突变相关。
原发性高草酸尿症1型(PH1) 是由肝脏特异性过氧化物酶体酶丙氨酸-乙醛酸氨基转移酶 (AGT) 缺乏引起的,是最严重的原发性高草酸尿症形式,约占具有遗传特征的患者的 80%。它可以表现为婴儿型草酸盐贮积症,导致早逝,但更典型的病程是复发性尿石症伴进行性肾钙质沉着症和 20-30 岁时发生的终末期肾病。佳学基因《原发性高草酸尿症的致病性基因突变》总共收录了超过178 种A**T突变;最常见的三种 p.G170R、c.33dupC 和 p.I244T 分别约占A**T的 30%、11% 和 6%突变等位基因;p.I244T 在西班牙/北非人群中很常见。
AGXT p.G170R 与 AGT 同源二聚体错误靶向线粒体以及相关的“次要”p.P11L/p.I340M 单倍型 p.P11L 线粒体靶向序列 (MTS) 的暴露有关。 p.G170R 患者的肾脏疾病较轻,对吡哆醇治疗有反应,吡哆醇是一种减少酶错误靶向的辅助因子。突变 p.G41R、p.F152I 和 p.I244T 如果存在于次要等位基因上,也会暴露线粒体靶向序列,而且基因解码证据表明 p.F152I 患者受益于吡哆醇治疗。检测需要次要等位基因 (MiR) 变异之外的基因型-表型相关性因等位基因异质性和显着的表型变异性而变得复杂,无论是在家族内还是在具有相同等位基因组合的无关患者中,都表明存在环境和修饰基因的作用。_
原发性高草酸尿症2型(PH2) 通常没有 原发性高草酸尿症1型(PH1) 严重,但首次出现症状的年龄相似。它是由乙醛酸还原酶/羟基丙酮酸还原酶 (GR/HPR) 缺乏引起的,约占具有遗传特征的原发性高草酸尿症病例的 10%。迄今为止,佳学基因原性高草酸尿症已收录了 28 种不同的突变,其中 c.103delG 和 c.403_404+2delAAGT 分别占突变等位基因的 37% 和 18%;c.403_404+2delAAGT 主要是在亚洲人中发现的突变。
原发性高草酸尿症3型(PH3)是最不严重的形式,大多数患者的肾功能都得到了很好的保护。典型的表现是复发性尿路结石和第一个十年明显的高钙尿症,但后来结石形成不太活跃。H**A1编码肝脏特异性线粒体酶 4-羟基-2-氧代戊二酸醛缩酶 (HOGA),突变导致羟基-2-氧代戊二酸醛缩酶积聚,从而抑制 GR/HPR 功能。原发性高草酸尿症3型(PH3)约占遗传特征病例的 10%,其中一些携带者被发现是特发性结石形成者,表明对单倍体不足敏感。c.700+5G>T的突变有19个,约占所有H**A1等位基因的50%;p.E315del 主要存在于德系犹太人中。没有为原发性高草酸尿症2型(PH2) 或原发性高草酸尿症3型(PH3)建立等位基因相关性。
在这里,原发性高草酸尿症基因检测使用来自肾结石联盟原发性高草酸尿症登记处(RKSC原发性高草酸尿症登记处)的大量原发性高草酸尿症患者,评估了基因和等位基因水平的基因型-表型相关性。此外,原发性高草酸尿症基因检测使用可用的全外显子组测序数据来提供基于人群的原发性高草酸尿症患病率估计。总体而言,这些研究为原发性高草酸尿症表型和特定等位基因的重要性提供了新的见解。此外,它们表明携带率远高于临床人群的估计值,表明存在显着的漏诊和/或不完全外显率/可变表达率。
原发性高草酸尿症基因检测结果
原发性高草酸尿症基因检测数据库的基因和等位基因分析
原发性高草酸尿症基因检测使用 Sanger 测序对 301 个原发性高草酸尿症家族(355 名患者)中的三个已知原发性高草酸尿症位点进行了突变筛选。其中,68.4%(206 个家系,247 名患者)为原发性高草酸尿症1型(PH1),9.3%(28 个家系,35 名患者)为原发性高草酸尿症2型(PH2),11.0%(33 个家系,38 名患者)为PH3。在每种情况下检测到两个突变等位基因。其余 11.3%(34 个家系,35 名患者)根据原发性高草酸尿症基因检测数据库具有与原发性高草酸尿症一致的临床表型,但在已知基因中未检测到突变(NMD)。
总共,原发性高草酸尿症基因检测在该队列中鉴定了 121 个不同的突变(83 个A**T、21 个G***R和 17 个H**A1),其中 36 个之前未在人类基因突变数据库 (HGMD 2013.3 Professional) 或原发性高草酸尿症突变数据库 (PHMD: 18 A**T、13 G***R和 5 H**A1). 其中一个新突变G***R c.[-4G>A, -3C>T] 位于转录起始密码子的上游,产生具有更强 Kozak 共识的移码新起始位点(补充图 2A )。
表1:在原发性高草酸尿症基因检测数据加中发现的新致病变异
| 基因/外显子/IVS | cDNA _ | 蛋白质 | 计算机分析得分b | 第二个等位基因c | 数据号c |
|---|---|---|---|---|---|
| AGXT | |||||
| 1 | c.34_35dupAA | p.K12fs | – | c.34_35dupAA | 393–01 |
| 1 | c.126dupG | p.L43fs | – | c.126dupG | 287–01 |
| 2 | c.188G>A | p.G63D | C65/影响蛋白/可能损坏;7/7 | p.G63D | 400–01 |
| 2 | c.292G>C | p.D98H | C0/影响蛋白/概率破坏;6/7 | p.D98H | 401-01 |
| 2 | c.299_307dupTCCTGGTTG | p.V102_G103insVLV | – | p.S158L | 115–01 |
| 3 | c.402C>G | p.Y134* | – | p.Y134* | 419–01 |
| 4 | c.469delG d | p.E157fs | – | p.G170R | 157–01 |
| 5 | c.560C>A | p.S187Y | C15/影响蛋白/可能损坏;6/7 | p.G170R | 369–01 |
| 5 | c.560_561insGGT | p.S187_L188insG | – | c.560_561insGGT | 69–01 |
| IVS5 | c.595+1G>T | p.G200fs | 供体剪接位点消除 | c.595+1G>T | 104–01 |
| 8 | c.779A>G | p.Y260C | C45/影响蛋白/可能损坏;5/7 | p.Y260C | 117–01 |
| 8 | c.781C>G | p.H261D | C65/影响蛋白/可能损坏;7/7 | c.33dupC | 171–01 |
| 8 | c.815T>C | p.L272P | C65/影响蛋白/可能损坏;7/7 | p.L272P | 462–01 |
| 8 | c.832delC | p.A277fs | – | p.S158* | 218–01 |
| 10 | c.949C>T | p.R317W | C65/影响蛋白/可能损坏;7/7 | p.G190R | 155–01 |
| 10 | c.973delG | p.A325fs | p.I279T | 182–01 | |
| 11 | c.1078C>T | p.R360W | C65/影响蛋白/可能损坏;7/7 | c.33dupC | 153–01 |
| 11 | c.1084G>A d | p.G362S | C55/影响蛋白/可能损坏;7/7 | c.847–3C>G | 43–01 |
| G**PR | |||||
| 1 | c.[-4G>A, -3C>T] | p.M1ext-4 | WT (0.67) 至 Mut (0.71) e | c.103delG | 376–02 |
| 3 | c.271delG | p.D91fs | – | p.S209F | 380–02 |
| 3/IVS3 | c.287_287+4delGGTAAinsCCC | p.R96fs | 供体剪接位点消除 | c.287_287+4delGGTAAinsCCC | 432–02 |
| 4 | c.337G>T | p.E113* | – | p.R302P | 28–02 |
| IVS4 | c.404+5G>A | p.N135fs | WT (0.99) 到 Mut (0.34) f | c.103delG,c.103delG,p.N135* | 34–02、356–02、147–02 |
| 5 | c.454dupA | p.T152fs | – | c.103delG,c.103delG | 184–02, 191–02 |
| 7 | c.626C>T | p.S209F | C65/影响蛋白/可能损坏;7/7 | c.271delG, c.769dupG | 380–02, 78–02 |
| 7 | c.694delC | p.Q232fs | – | c.694delC | 333–02 |
| IVS7 | c.734+1G>A | p.R246fs | 供体剪接位点消除 | p.A297T | 213–02 |
| 8 | c.769dupG | p.Q256fs | – | p.S209F | 78–02 |
| 9 | c.889G>A | p.A297T | C55/影响蛋白/可能损坏;7/7 | c.734+1G>A | 213–02 |
| 9 | c.890_891dupCC | p.T298fs | – | p.E113K | 135–02 |
| 9 | c.905G>C | p.R302P | C65/影响蛋白/可能损坏;7/7 | p.E113* | 28–02 |
| H**A1 | |||||
| 2 | c.227G>A | p.G76D | C65/影响蛋白/可能损坏;7/7 | p.M292T | 282–03 |
| 2 | c.308A>T克 | p.N103I g | C55/影响蛋白/良性;1/7 | c.700+5G>T | 362–03 |
| 4 | c.533T>C h | p.L178P h | C65/影响蛋白/可能损坏;7/7 | p.P179T | 457–03 |
| 4 | c.535C> Ah | p.P179T h | C35/影响蛋白质/可能破坏;7/7 | p.L178P | 457–03 |
| 7 | c.973G>A | p.G325S | C55/影响蛋白/可能损坏;7/7 | c.700+5G>T | 193–03 |
a基于NM_000030.2 ( A**T )、NM_012203.1 ( G***R ) 和NM_138413.3 ( H**A1 ) 的核苷酸编号。
b新型错义突变的计算机评估:AlignGVGD/SIFT/PolyPhen-2 和与多序列比对的同一性(人、公牛、小鼠、大鼠、狗、鸡和斑马鱼)。
c第二个等位基因是根据系谱顺序列出的。
d在 Mandrile等人最近发表的文章中,这些变体也被确定为新的AGXT等位基因。
使用 NetStart 1.0对Kozak 突变进行评分;更高的分数更有可能充当转录起始密码子。
f使用 BDGP 评估了新的剪接;分数越高,越有可能充当剪接位点。
不同基因之间的基因型和等位基因分解差异很大(图1). 例如,50.0% 的 原发性高草酸尿症2型(PH2) 谱系包含两个截短突变,这是一种等位基因组合,仅占原发性高草酸尿症1型(PH1) 基因型的少数(14.1%),而在原发性高草酸尿症3型(PH3)中不存在(图 1A). G***R更容易发生移码插入缺失(插入、复制、缺失或插入+缺失),占所有突变等位基因的 44.6%,而大多数A**T突变是错义 (67.0%)(图 1B). 这些富集是由常见的突变驱动的;在 50.5% 的 原发性高草酸尿症1型(PH1) 家族中发现了 A**T 错误定位变化 p.G170R,在35.7%的原发性高草酸尿症2型(PH2) 家族中发现了G***R c.103delG。H**A1 的两个最常见等位基因(c.700+5G>T 和 p.E315del)表现出相当低的等位基因异质性,占总数的 74.2%(图 1B).
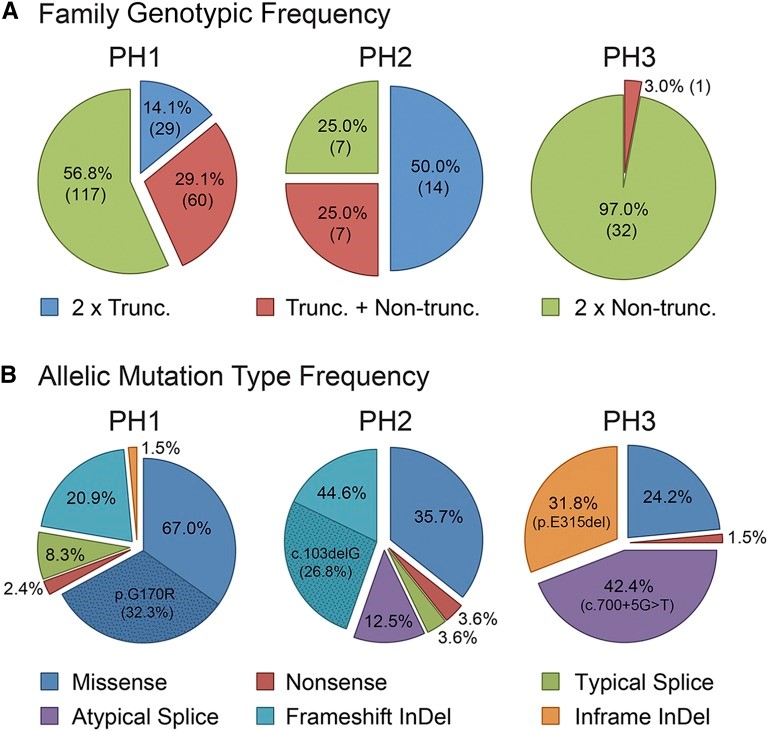
图1:基因型和等位基因分解在突变解决的 267 个谱系中的不同原发性高草酸尿症类型之间有很大差异。(A) 按原发性高草酸尿症类型划分的基因型分解显示患者具有两个截短等位基因(无义、剪接和移码插入缺失 [插入、重复、缺失或插入+缺失])、两个非截短等位基因(错义和框内插入缺失)或截短加号一个非截断等位基因。括号中的数字表示具有该基因型的家庭数量。(B) 不同突变类型的原发性高草酸尿症类型的等位基因分析。还突出显示了每种原发性高草酸尿症类型的常见等位基因及其频率。A**T p.G170R 在 29 个家族中发现纯合子 (hom),在 75 个家族中发现杂合子 (het),G***R c.103delG(hom,5 个家庭;het,5 个家庭),H**A1c.700+5G>T(hom,8 个家庭;het,12 个家庭),H**A1 p.E315del(hom,7 个家庭;het,7 个家庭)。
PH 类型之间的基因型-表型比较
在原发性高草酸尿症的队列中,PH 症状发作的中位年龄(第 25、75 个百分位数)为 5.2 岁(1.7、15 岁),最后一次接触的年龄为 21 岁(9、43 岁)。迄今为止,355 名患者中有 22 人死亡,139 人发展为 ESRD。肾脏生存分析表明,原发性高草酸尿症1型(PH1) 患者更有可能达到 ESRD 并且年龄更早,其次是原发性高草酸尿症2型(PH2),然后是 PH3(图 2A)。没有 NMD 患者在 60 岁时发生过 ESRD (图 2A), 尽管两人后来出现肾功能衰竭。原发性高草酸尿症1型(PH1) 患者肾钙质沉着症的发生率较高,尿液草酸盐、钙和柠檬酸盐水平较低(表 2)。原发性高草酸尿症3型(PH3)患者的症状发作早于原发性高草酸尿症1型(PH1) 或原发性高草酸尿症2型(PH2) 患者,但尿草酸盐排泄量较低,而且一般来说,疾病进展更慢。NMD 患者是最新出现症状的患者,其草酸盐水平与原发性高草酸尿症3型(PH3)患者相似。乙醇酸或l-甘油酸水平升高分别表示原发性高草酸尿症1型(PH1) 或原发性高草酸尿症2型(PH2)(表 2)。
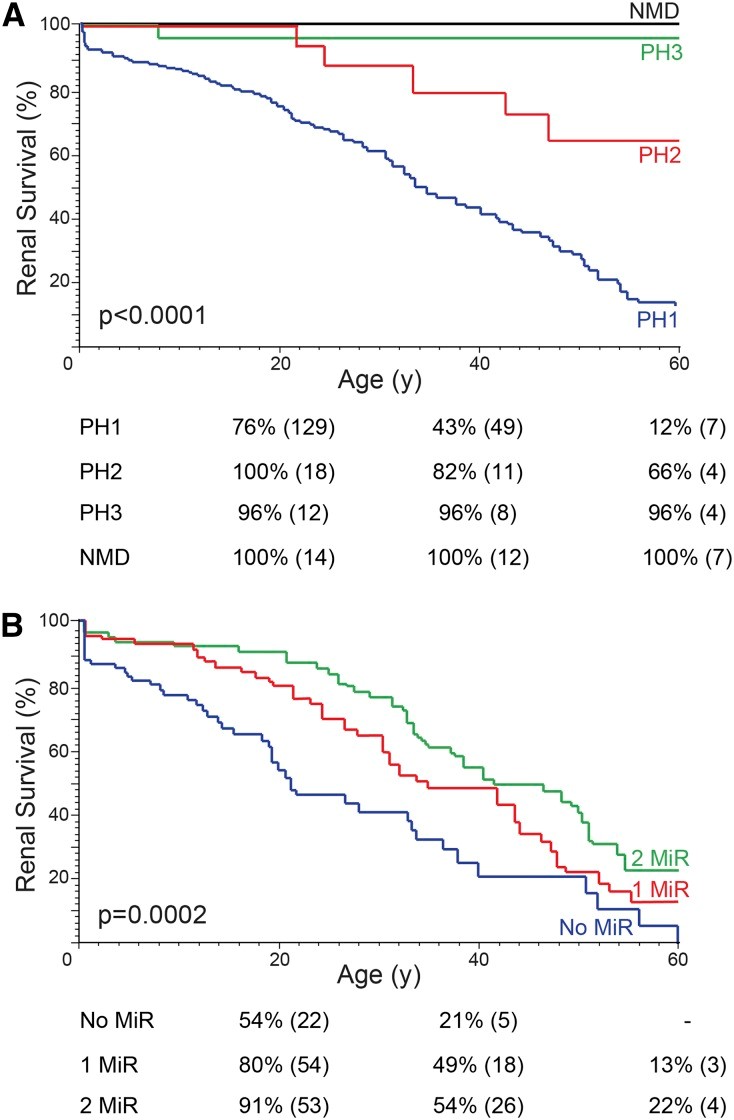
图2:肾脏存活图显示 (A) 原发性高草酸尿症1型(PH1) 患者的肾脏存活率较差,然后是 原发性高草酸尿症2型(PH2),和 (B) 具有两个 MiR 等位基因的 原发性高草酸尿症1型(PH1) 患者的肾脏存活率较好。(A) 原发性高草酸尿症1型(PH1)、原发性高草酸尿症2型(PH2)、原发性高草酸尿症3型(PH3)和 NMD 队列的 Kaplan-Meier 肾脏存活图。(B) 原发性高草酸尿症1型(PH1) 患者的 Kaplan-Meier 肾脏存活图被归类为具有两个 MiR 等位基因(纯合子或复合杂合子;AGXT p.G41R、p.F152I、p.G170R、p.I244T,89 名患者),一个 MiR 等位基因在与非 MiR 等位基因(97 名患者)或两个均不是 MiR 等位基因的等位基因(无 MiR,81 名患者)组合。Kaplan-Meier 图下方的表格显示了生存估计值,括号中为处于风险中的患者数量。
表 2:基于原发性高草酸尿症类型的 RKSC原发性高草酸尿症患者的临床表现
| 参数 | PH1(n = 247) | PH2(n =35) | PH3(n =38) | NMD(n = 35) | 调整后的P值 |
|---|---|---|---|---|---|
| 出现症状的年龄 | 0.01 | ||||
| 中位数 ( y ) | 5.2 | 7.4 | 2.6 | 11.5 | |
| Q1, Q3 ( y ) | (2.0, 14.0) | (1.7, 15.8) | (0.9, 5.5) | (3.9, 24.1) | |
| 最小值、最大值 ( y ) | (0.1, 53.0) | (0.6, 42.0) | (0.3, 31.0) | (0.1, 69.7) | |
| 患者 ( n ) | 213 | 31 | 33 | 29 | |
| 肾钙质沉着症,n (%) | <0.0001 | ||||
| 是 | 49 (30.6) | 5 (16.7) | 1 (2.7) | 5 (16.7) | |
| 不 | 111 (69.4) | 25 (83.3) | 36 (97.3) | 25 (83.3) | |
| 尿化学 | |||||
| Ox24 (mmol/1.73 m 2 )(正常 < 0.46)a | <0.0001 | ||||
| 中位数 | 1.8 | 1.7 | 1.1 | 1.2 | |
| Q1、Q3 | (1.2, 2.7) | (1.1, 2.2) | (0.9, 1.4) | (1.0, 1.5) | |
| 患者 ( n ) | 121 | 23 | 34 | 23 | |
| Ca24 (mg/1.73m 2 )(正常 100–300)a | <0.0001 | ||||
| 中位数 | 56.8 | 91.5 | 91.4 | 135.9 | |
| Q1、Q3 | (34.1, 91.2) | (55.8, 134.2) | (63.5, 153.0) | (79.9, 236.8) | |
| 患者 ( n ) | 82 | 19 | 26 | 20 | |
| Cit24 (mg/1.73 m 2 )(正常 320–1240)a | <0.0001 | ||||
| 中位数 | 278.5 | 722.9 | 676.9 | 371.0 | |
| Q1、Q3 | (108.2, 488.3) | (245.2, 1285.0) | (416.3, 812.9) | (289.3, 954.5) | |
| 患者 ( n ) | 74 | 15 | 27 | 20 | |
| 乙醇酸盐(mg/g 肌酐)(正常 0–78)b | <0.0001 | ||||
| 中位数 | 102.2 | 28.0 | 18.0 | 33.0 | |
| Q1、Q3 | (46.5, 218.0) | (22.0, 41.0) | (8.0, 42.0) | (14.0, 54.0) | |
| 患者 ( n ) | 96 | 22 | 23 | 22 | |
| l -甘油酸(mg/g 肌酐)(正常 0–8)b | <0.0001 | ||||
| 中位数 | 3.0 | 785.0 | 1.0 | 7.0 | |
| Q1、Q3 | (2.0, 9.0) | (271.0, 1467.0) | (0.0, 6.0) | (2.0, 11.0) | |
| 患者 ( n ) | 91 | 19 | 21 | 21 |
Q1、Q3、第一和第三四分位数;Ox24,24 小时草酸盐;Ca24,24小时钙;Cit24,24 小时柠檬酸盐。
a正常值适用于成年患者。表中的值已针对体表面积进行了调整,以便对成人和儿童患者进行比较。52 , 53
b出生至 5 岁儿童的正常值可能更高。
等位基因与 原发性高草酸尿症1型(PH1) 表型的关联
为了比较AGXT基因型与 原发性高草酸尿症1型(PH1) 表型,我们通过突变类型的组合来表征患者,定义为截短、非截短或 MiR(p.G41R、p.F152I、p.G170R、p.I244T),并假设非截短/ MiR 突变可能仍有一些残留功能。具有两个 MiR 突变的患者出现症状较晚,进展为 ESRD 的速度较慢,并且草酸盐和乙醇酸盐水平低于任何其他基因型的患者(图 2B,补充表 1 ,表3). 这些结果与 p.G170R 25的先前发现一致,并突出了这些等位基因的不完全外显率/可变表达性。当排除 MiR 突变时,具有两个截短或两个非截短突变的患者之间的表型没有显着差异(补充图 3,补充表 2),这表明非 MiR、非截短等位基因通常完全失活。然而,我们确实注意到与那些没有 MiR 等位基因的杂合子相比,那些具有 MiR 等位基因的杂合子具有肾脏生存益处,如先前报道的 p.G170R(图 2B). 25这种较温和的表型也可以通过较低的尿液乙醇酸盐水平来证明,但不能通过其他尿液化学、发病年龄或肾钙质沉着症的发生率来证明(表3). 为了评估是否所有 MiR 等位基因在表型方面表现相似,我们将 p.G170R 与其他 MiR 等位基因(p.G41R、p.F152I、p.I244T)分开。Kaplan-Meier 肾生存曲线显示只有 p.G170R 纯合子的疾病较轻,其他 MiR 等位基因纯合的患者则不然(图 3). p.G170R 的生存优势仍然存在,尽管显着性下降,即使在肾衰竭前调整吡哆醇治疗后也是如此(图 3); 这发生在 53% 的 p.G170R 纯合子、26% 的其他 MiR 纯合子和 38% 没有 MiR 等位基因的患者中。接受治疗的患者比例在各组之间没有显着差异(P = 0.14)。因此,尽管所有 MiR 等位基因都揭示了功能性 MTS,但它们的外显率存在显着差异。29
表3:根据每个基因型的 MiR 变体数量评估 原发性高草酸尿症1型(PH1) 严重程度
| 多变的 | Hom MiR(n = 69) | Het MiR(n = 97) | 没有 MiR(n = 81) | 调整后的P值 |
|---|---|---|---|---|
| 出现症状的年龄 | 0.006 | |||
| 中位数 ( y ) | 10.6 | 4.7 | 4.3 | |
| Q1, Q3 ( y ) | (2.4, 22.0) | (1.7, 12.4) | (0.7, 8.4) | |
| 最小值、最大值 ( y ) | (0.5, 49.8) | (0.1, 53.0) | (0.1, 41.5) | |
| 患者 ( n ) | 59 | 86 | 68 | |
| 肾钙质沉着症,n (%) | 0.08 | |||
| 是的 | 7 (18.4) | 21 (30.4) | 21 (39.6) | |
| 不 | 31 (81.6) | 48 (69.6) | 32 (60.4) | |
| 尿化学 | ||||
| Ox24 (mmol/1.73 m 2 )(正常 < 0.46)a | <0.001 | |||
| 中位数 | 1.1 | 2.0 | 2.3 | |
| Q1、Q3 | (0.7, 1.7) | (1.3, 2.6) | (1.7, 2.9) | |
| 患者 ( n ) | 26 | 63 | 32 | |
| Ca24 (mg/1.73m 2 )(正常 100–300)a | 0.10 | |||
| 中位数 | 79.5 | 54.1 | 54.9 | |
| Q1、Q3 | (29.0, 157.5) | (35.8, 78.6) | (32.7, 69.2) | |
| 患者 ( n ) | 19 | 42 | 21 | |
| Cit24 (mg/1.73 m 2 )(正常 320–1240)a | 0.71 | |||
| 中位数 | 402.5 | 275.7 | 281.7 | |
| Q1、Q3 | (125.4, 584.7) | (112.7, 436.2) | (87.9, 471.6) | |
| 患者 ( n ) | 16 | 36 | 22 | |
| 乙醇酸盐(mg/g 肌酐)(正常 0–78)b | 0.002 | |||
| 中位数 | 45.0 | 96.0 | 182.0 | |
| Q1、Q3 | (19.0, 143.0) | (48.0, 182.0) | (89.0, 310.0) | |
| 患者 ( n ) | 23 | 47 | 26 |
Hom,纯合子;Het,杂合子;Q1、Q3、第一和第三四分位数;Ox24,24 小时草酸盐;Ca24,24小时钙;Cit24,24 小时柠檬酸盐。
a正常值适用于成年患者。表中的值已针对体表面积进行了调整,以便对成人和儿童患者进行比较。
b出生至 5 岁儿童的正常值可能更高。
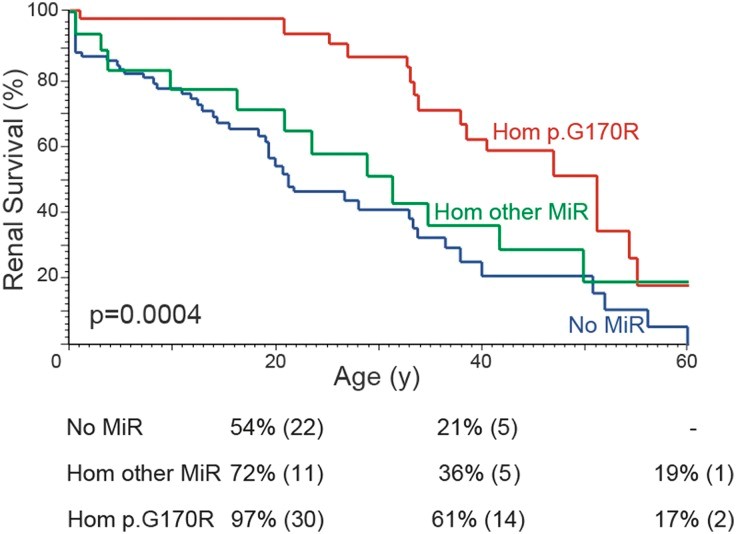
图 3:肾脏存活图显示只有 p.G170R 纯合子患者而非其他 MiR 基因型的纯合子患者具有肾脏存活优势。P.G170R 纯合子(34 名患者)、另一个 MiR 等位基因纯合子或复合杂合子(p.G41R、p.F152I、p.I244T,19 名患者)或具有无 MiR 等位基因(81 名患者)。成对比较显示,与没有 MiR 等位基因的患者相比,具有AGXT p.G170R 而不是其他 MiR 等位基因的纯合子患者的肾脏存活率更高(Hom p.G170R 与无 MiR;P <0.0001 [ P <0.001],Hom 其他 MiR 与无MiR P =0.27 [ P =0.35],Hom p.G170R 与 Hom other MiR P=0.04 [ P =0.05])。方括号中的P值针对吡哆醇处理的效果进行了调整,降低了整体显着性但维持了AGXT p.G170R 纯合子的生存优势。
等位基因与 原发性高草酸尿症2型(PH2) 和 原发性高草酸尿症3型(PH3)表型的关联
为了评估基因检测数据库原发性高草酸尿症2型(PH2) 队列中的基因型-表型相关性,根据突变类型(两个截短、两个非截短或一个截短加一个非截短等位基因)对患者进行分组。然而,未观察到与出现症状时的年龄或 ESRD、肾钙质沉着症和尿液化学有显着关联(补充表 3)。
原发性高草酸尿症3型(PH3)患者按常见突变(c.700+5G>T 或 p.E315del 的纯合子;c.700+5G>T/p.E315del 的杂合子、复合杂合子,或缺少这些突变)分组。至于原发性高草酸尿症2型(PH2),在基因检测数据库相对较小的原发性高草酸尿症3型(PH3)队列中没有明显的基因型-表型关联。有趣的是,一名 原发性高草酸尿症3型(PH3)患者在 8 岁时发展为 ESRD。该患者是一对密切相关的非保守错义变异的纯合子,预计具有高致病性,而不是常见的H**A1等位基因。该患者在 18 个月大时出现症状,有多处草酸钙结石已通过手术切除;CKD 在 6 岁时首次被发现,至少部分归因于阻塞性尿路病。
具有相同基因型的患者和家族内的疾病变异性
在原发性高草酸尿症1型(PH1) 中观察到具有相同等位基因组合的患者的家族内可变疾病表达和表型异质性。在当前队列中,五个原发性高草酸尿症1型(PH1) 家族在 ESRD 发作时间方面的兄弟姐妹之间存在 >20 年的差异,并且特定 A**T 等位基因纯合的患者之间存在相当大的表型变异性(补充表5A )。在原发性高草酸尿症2型(PH2) 和原发性高草酸尿症3型(PH3)队列中,常见突变的纯合子也表现出相当大的疾病表达变异性。在一个 原发性高草酸尿症2型(PH2) 家族内GRHPR纯合子c.103delG,三个受影响的兄弟姐妹中的一个在 21 岁时达到了 ESRD,而另外两个表现出偶尔的结石病,eGFR 在 56 岁和 53 岁时分别为 40 和 85 ml/min/1.73 m 2。
使用全外显子组测序基因检测数据估计原发性高草酸尿症患病率
从外显子组测序项目 (ESP) 数据中,佳学基因提取了在 4300 个人中发现的22 个已知原发性高草酸尿症突变(12 个 A**T、5 个 G***R 和 5 个 H**A1 )的等位基因计数( EA) 和 2203 名中另一种群。此外,佳学基因包括了所有移码或无意义的变化,并对所有以前未使用计算机工具确定为原发性高草酸尿症突变的罕见非同义变异进行评分,从而确定了 20 个额外的可能致病变异(4 个A**T、6 个G***R和 10 个H**A1)。使用 Hardy-Weinberg 方程,从 22 个已知的突变等位基因计算出 1:71 的总体原发性高草酸尿症载波频率 (CF) 和 1:58,243 的预测患病率。包括预测的致病等位基因在内,CF 和患病率分别增加到 1:58 和 1:38,630。预测原发性高草酸尿症在 AA 中的患病率比在 EA 中低约 60%(EA:CF,1:61,患病率,1:40,276;AA:CF,1:104,患病率,1:100,380)(表 4)。这种差异主要是由常见的 EA 等位基因HOGA1 c.700+5G>T (CF, 1:165; AA: CF, 1:1102) (图 4)。原发性高草酸尿症1型(PH1) 在 EA 和 AA 中的流行率相似,尽管AGXT p.G170R(EA:CF,1:429)是 EA 人群所特有的,但被最流行的 AA 等位基因AGXT p.R289H 平衡,它占对于大约 33% 的所有 AA 突变等位基因(CF,1:289;EA:CF,1:1956)(图 4)。有趣的是,AGXT “次要”等位基因变异 p.P11L/p.I340M 在 AAs 中的流行率比 EAs 低 15 倍(EA:CF,1:3,流行率,1:15;AA:CF,1:8,流行率, 1:236)。与 原发性高草酸尿症1型(PH1) 一样,原发性高草酸尿症2型(PH2) 在 EA 和 AA 中的患病率也相似,因为GRHPR c.103delG 在两个人群中都相对常见(EA:CF,1:375;AA:CF,1:426)(图 4)。
表 4:基于 NHLBI ESP 中发现的原发性高草酸尿症突变等位基因的携带者频率和流行率
| 参数 | EA患者 | AA患者 | 所有患者 (EA + AA) |
|---|---|---|---|
| 原发性高草酸尿症1型(PH1)+原发性高草酸尿症2型(PH2)+PH3 | |||
| 等位基因计数(Alt/Ref) | 70/8495 | 21/4361 | 91/12,856 |
| 突变等位基因频率 (%) | 0.824 | 0.482 | 0.708 |
| 流行率(1 in)a | 40,276 | 100,380 | 58,243 |
| CF(1 in)一个 | 61 | 104 | 71 |
| 原发性高草酸尿症1型(PH1) ( AGXT ) | |||
| 等位基因计数(Alt/Ref) | 22/8502 | 11/4359 | 33/12,861 |
| 突变等位基因频率 (%) | 0.259 | 0.252 | 0.257 |
| 患病率(1 in) | 149,347 | 157,032 | 151,887 |
| 碳纤维 (1 in) | 194 | 199 | 195 |
| 原发性高草酸尿症2型(PH2) ( GRHPR ) | |||
| 等位基因计数(Alt/Ref) | 15/8459 | 8/4348 | 23/12,807 |
| 突变等位基因频率 (%) | 0.177 | 0.184 | 0.180 |
| 患病率(1 in) | 318,021 | 295,392 | 310,055 |
| 碳纤维 (1 in) | 282 | 272 | 279 |
| 原发性高草酸尿症3型(PH3)( HOGA1 ) | |||
| 等位基因计数(Alt/Ref) | 33/8524 | 2/4377 | 35/12,901 |
| 突变等位基因频率 (%) | 0.387 | 0.046 | 0.271 |
| 患病率(1 in) | 66,720 | 4,789,532 | 135,866 |
| 碳纤维 (1 in) | 130 | 1095 | 185 |
a患病率是通过将所有原发性高草酸尿症类型的个体患病率与计为携带者的生物原发性高草酸尿症病例相结合来确定的。

当按原发性高草酸尿症类型分开时,原发性高草酸尿症1型(PH1) 和 原发性高草酸尿症3型(PH3)具有相似的 CF(1:195 对 1:185)和患病率(1:151,887 对 1:135,866)(表 4),而在佳学基因所做的患者筛查中,原发性高草酸尿症1型(PH1) 的发生率高出六倍(68.4% 的家庭对 11.0%)。这些数据表明 原发性高草酸尿症3型(PH3)存在明显的诊断不足和/或缺乏外显率。原发性高草酸尿症3型(PH3)的频率主要由HOGA1 c.700+5G>T 驱动,其在 ESP 数据中的 CF(232 人中有 1 人)比AGXT p.G170R(649 人中有 1 人)高约 2.8 倍,但它们占 5.2在我们的患者队列中,分别占所有原发性高草酸尿症等位基因的 % 和 24.9%。根据这些计算,预测 原发性高草酸尿症2型(PH2) 的流行率比 原发性高草酸尿症1型(PH1) 或 原发性高草酸尿症3型(PH3)低约 2.2 倍(CF,1:279;流行率,1:310,055)(表 4),但在我们的疾病队列中,其患病率与 原发性高草酸尿症3型(PH3)相似,比 原发性高草酸尿症1型(PH1) 少大约七倍。
原发性高草酸尿症基因检测讨论
在这里,原发性高草酸尿症基因检测展示了的完全基因分型原发性高草酸尿症队列之一的基因型-表型相关性,并根据大量人口数据计算原发性高草酸尿症患病率。由于人口规模,原发性高草酸尿症基因检测显着增加了独特原发性高草酸尿症突变的数量(AGXT增加了 10.1%,GRHPR增加了 46.4%,HOGA1增加了 26.3%)。该分析强调了这些疾病的等位基因异质性,尽管一些常见等位基因的群体重要性也得到了加强(图1). 虽然升高的尿液乙醇酸、 l-甘油酸、或 HOGA 水平通常可以提供有关原发性高草酸尿症基因相关的有力证据(表 2),原发性高草酸尿症类型和正常个体之间存在显着重叠。因此,原发性高草酸尿症基因检测在这里强调分子分析作为诊断原发性高草酸尿症的金标准方法的价值。随着测序成本的下降和新方法的采用,实施全面筛查所有基因编码区(而不仅仅是常见的遗传变异)并彻底评估所有检测到的变异的方案变得越来越实用。
原发性高草酸尿症基因检测在突变解决家庭中的基因流行率——77.1% 原发性高草酸尿症1型(PH1)、10.5% 原发性高草酸尿症2型(PH2)、12.4% PH3——与之前的估计一致(原发性高草酸尿症1型(PH1),80%;原发性高草酸尿症2型(PH2),10%;PH3,10%),并强调 原发性高草酸尿症1型(PH1) 是最常见的形式,而原发性高草酸尿症3型(PH3)现在至少和 原发性高草酸尿症2型(PH2) 一样普遍。有趣的是,原发性高草酸尿症基因检测临床定义的队列(34 个家系)中有 11.3% 在已知原发性高草酸尿症基因中未检测到突变。鉴于这些家族的表型(见下文)和分子诊断的可靠性(在 NMD 组中未检测到单个原发性高草酸尿症突变),PH 的进一步遗传异质性似乎很可能。尽管 NMD 病例符合 RKSC原发性高草酸尿症注册标准(简明方法),但首次症状出现的时间比基因定义的原发性高草酸尿症晚 4-9 年(表 2),尿草酸盐排泄低于 原发性高草酸尿症1型(PH1) 和 原发性高草酸尿症2型(PH2)(但与 原发性高草酸尿症3型(PH3)相似),并且 ESRD 很少见,尽管存在相当大的家庭间变异性。这些数据表明需要严格的临床/分子评估来确定适合原发性高草酸尿症进一步基因发现工作的人群。
原发性高草酸尿症基因检测的原发性高草酸尿症1型(PH1) 队列显示了较小队列中报告的许多特征;两个AGXT变体占 原发性高草酸尿症1型(PH1) 突变等位基因的 47.8%(p.G170R [32.3%] 和 c.33dupC [15.5%]),大多数突变是错义的,即使在排除常见等位基因之后(图1). 原发性高草酸尿症1型(PH1)是最严重的PH类型(图 2,表 2),首发症状的中位年龄(5.2 岁)和累积肾脏存活率(20 岁、40 岁和 60 岁时分别为 76%、43% 和 12%)与文献报道的相似。此外,尽管乙醇酸盐的尿液排泄升高提示 原发性高草酸尿症1型(PH1),但范围(6.0–1183.0 mg/g 肌酐)与其他原发性高草酸尿症类型和 NMD 患者重叠(最小、最大尿乙醇酸盐 mg/g 肌酐: 原发性高草酸尿症2型(PH2), 0.0, 105.0; PH3, 0.0, 116.0; NMD, 1.0, 168.0) (表 2), 表明单独的乙醇酸盐分析不能明确识别这种原发性高草酸尿症形式。4个 MiR 等位基因之一纯合的患者原发性高草酸尿症1型(PH1) 较轻(图 2,表3),正如 p.G170R 所建议的那样,但将 p.G170R 与其他 MiR 等位基因分开强调了晚期 ESRD 仅与 p.G170R 相关(图 3); 其他 MiR 患者的肾脏存活率与具有截短或非 MiR 非截短等位基因的患者相似。这些结果强调了 p.G170R 的不完全渗透性质/可变表达性,并表明其他 MiR 等位基因的不同病理机制,例如单体聚集或活性位点破坏,如 p.G41R 所示。对于考虑对具有其他 MiR 等位基因的患者进行吡哆醇治疗很重要,因为该辅助因子被认为可以稳定单体/二聚体。然而,轶事证据表明多种AGXT突变患者(包括 p.F152I 或两个截短等位基因)对吡哆醇有反应,表明可能存在吡哆醇的替代治疗益处(例如,对基因表达和/或酶活性的影响)。
原发性高草酸尿症基因检测发现具有两个非 MiR 非截断等位基因与两个截断等位基因的患者之间的表型没有差异,表明所有这些AGXT等位基因都完全失活。这与最近的一份研究形成对比,该研究报告了具有两个非 p.G170R 非截短变体的患者与两个截短变体相比具有更好的肾脏存活率(16.9 年对 9.9 年)。尽管原发性高草酸尿症基因检测有可能没有观察到这种相关性,因为队列规模较小(RKSC原发性高草酸尿症注册中的 247 名患者与 OxalEurope 联盟中的 410 名患者),并且没有提供成对比较的意义。OxalEurope 研究人员还分析了特定错义变异之间的等位基因效应,但考虑到观察到的家族内/基因型内表型异质性,由于遗传/环境修饰效应,对这些小群体的解释需要谨慎。随着人口规模的增加和通过可用队列的汇总分析,将有可能对 原发性高草酸尿症1型(PH1) 进行更详细的等位基因分析。
在原发性高草酸尿症基因检测的队列中,原发性高草酸尿症2型(PH2) 在出现症状的年龄和草酸盐水平方面与 原发性高草酸尿症1型(PH1) 相似;然而,向 ESRD 的进展明显较慢(图 2,表 2).升高的尿液l-甘油酸水平将 原发性高草酸尿症2型(PH2) 病例与 原发性高草酸尿症1型(PH1) 和 原发性高草酸尿症3型(PH3)病例区分开来,但发现与遗传未解决组有一些重叠(最小、最大尿液l-甘油酸 mg/g 肌酐:原发性高草酸尿症1型(PH1),0.0,129.0;原发性高草酸尿症2型(PH2),151.0 , 4355.0; PH3, 0.0, 40.0; NMD, 0.0, 152.0)。同样,观察到显着的家族内/基因型内表型异质性,表明 原发性高草酸尿症2型(PH2) 中存在显着的遗传/环境修饰效应。在 原发性高草酸尿症2型(PH2) 患者中未检测到表型与突变类型的显着关联,尽管我们的队列可能太小而无法识别疾病严重程度的细微差异。有趣的是,大多数GRHPR突变等位基因发生移码,主要由常见的 c.103delG 变体驱动。
在原发性高草酸尿症基因检测的队列中,没有原发性高草酸尿症3型(PH3)家族有两个截断等位基因(图1),只描述了一名这样的患者。具有不同或未检测到 HOGA 水平的患者的表型分析将证明很有趣,并提供对大多数HOGA1等位基因是不完全还是完全渗透的深入了解,这与结构分析一致。有趣的是,一些HOGA1携带者表现出轻度高草酸尿症或特发性尿路结石病(与其他形式的原发性高草酸尿症不同),并且第一个报告的 原发性高草酸尿症3型(PH3)患者达到 ESRD 是两个新型连锁错义变异的纯合子; 表明更多的渗透突变可能具有更强的表型效应。然而,这名 原发性高草酸尿症3型(PH3)患者的 ESRD 可能至少部分因反复取石手术引起的肾损伤而加重。矛盾的是,原发性高草酸尿症3型(PH3)患者在最早的年龄出现症状,但随后病情相对较轻(图 2,表 2), 表明随着年龄的增长对 HOGA 水平的敏感性降低。两个最常见的HOGA1等位基因(c.700+5G>T 和 p.E315del)之间缺乏检测到的基因型-表型相关性可能再次是由于人口少和其他遗传/环境修饰效应。
这项研究最重要的发现是,从人口数据中计算出的总体携带者频率(大约 1:70)和推断患病率(大约 1:58,000)比临床研究的估计值大一个数量级。因为这些新的估计来自对已知突变等位基因的计数,并且主要由一些常见等位基因驱动,所以这项研究不太可能高估载体频率。原发性高草酸尿症1型(PH1) 患病率的估计值大约是先前估计值的两倍,但 原发性高草酸尿症3型(PH3)的差异更为显着,其观察到的人群携带频率高于 原发性高草酸尿症1型(PH1),但在目前确定的临床人群中常见率低 6 倍。原发性高草酸尿症2型(PH2) 的人群携带频率是 原发性高草酸尿症1型(PH1) 的一半,但在临床人群中的频率要低 7 倍以上。HOGA1 c.700+5G>T突变(图 4). 有趣的是,AGXT p.G170R 仅在 EA 中发现,而AGXT MTS 变体(p.P11L、p.I340M、次要单倍型)在 AA 中比 EA 中少得多(图 4)。这一发现表明,预测错误定位 AGT 的突变在 AAs 中通常可能保持无症状,因为 MTS 需要存在次要单倍型才能激活。有趣的是,由于最常见的 AA 突变AGXT p.R289H(在 PHMD 中报告22),EA 和 AA 之间的 原发性高草酸尿症1型(PH1) 流行率仍然相似。该变异比任何原发性高草酸尿症等位基因(不包括 EA:HOGA1 c.700+5G>T)明显更常见(图 4) 并且得分很低,40质疑其真正的致病性质。去除该等位基因将使 原发性高草酸尿症1型(PH1) 患病率降低 48%(CF,1:270;患病率,1:291,256),PH 总体患病率降低 18%(CF,1:79;患病率,1:71,333,补充表 9 )。此外,AA 中的 原发性高草酸尿症1型(PH1) 患病率将降低 87%(CF,1:549;患病率,1:1,203,908),AA 人群中的原发性高草酸尿症总体患病率将降低 56%(CF,1:156;患病率,1:225,971)。因此,PH 在 AA 中的流行率比在 EA 中低约 82%。
预期和观察到的患病率之间的差异,尤其是 原发性高草酸尿症3型(PH3)和 原发性高草酸尿症2型(PH2) 的程度较小,可能是由于这些疾病的诊断不足,这些疾病具有总体较温和的表型,并且比 原发性高草酸尿症1型(PH1) 导致 ESRD 的可能性小得多。此外,部分 原发性高草酸尿症1型(PH1) 患者(尤其是 p.G170R 纯合子)的疾病相对较轻,并且首次出现症状的年龄差异很大(表 2), 可能是 原发性高草酸尿症1型(PH1) 诊断不足的 2 倍。此外,将原发性高草酸尿症误诊为其他肾脏疾病,如肾结核患者AGXT突变的纯合性所示, 50也可能在低估原发性高草酸尿症患病率方面发挥作用。因此,特发性结石病人群和其他具有原发性高草酸尿症表型但没有已知突变的患者的原发性高草酸尿症基因型分析可能为未确诊的原发性高草酸尿症病例提供信息。事实上,根据已发表的诊断流程,在结石诊所环境中,对于不明原因的高草酸尿症和/或 CKD 患者,应仔细考虑原发性高草酸尿症的诊断。51这包括对尿液草酸盐和化学物质以及血浆草酸盐进行初步综合分析,然后对疑似病例的原发性高草酸尿症基因进行分子检测。



