【佳学基因检测】巨额花费肾移植,却得了视网膜纤毛病:基因检测在肾病与眼科共病中的作用
肾移植患者的视网膜纤毛病
虽然基因检测数据库中的RP1 基因的突变仅与一种非综合征形式的视网膜变性有关。然而基因解码却揭示RP1 蛋白在肾脏中表达,佳学基因提出了一个有趣的问题为什么该基因的突变仅与视网膜光感受器功能特异性相关,而与动脉高血压和肾脏疾病无关。初级纤毛被认为是血管内皮和肾脏中潜在的机械感觉流体流动受体,它们的功能障碍会导致动脉粥样硬化变化、高血压和慢性肾功能衰竭。
肾脏移植患者的视网膜纤毛病基因检测关键词
RP1基因,色素性视网膜炎,视网膜-肾纤毛病
1.视网膜疾病基本知识及其基因检测
初级纤毛是几乎所有人体组织和器官的进化上保守的、基于微管的特化细胞投射,除了血细胞 。初级纤毛从基底体内的母中心粒中生长出来,将它们与细胞对接。来自基体的小管扩张到初级纤毛的近端部分并形成称为轴丝的微管骨架,被基质和膜包围。初级纤毛的基部与近端由过渡区隔开,过渡区作为扩散屏障,组装了鞭毛内运输系统,其作用是控制多种蛋白质复合物的运动,对维持初级纤毛起重要作用。初级纤毛膜上的特异性定位受体感知细胞外信号并将其转化为控制组织和器官分化、发育和体内平衡的某些信号通路。由于视网膜和肾脏中存在原发性纤毛,编码原发性纤毛蛋白的基因突变会导致其结构或功能受损,这可能导致各种视网膜和肾脏综合征的多效性临床表现 .
部分遗传性视网膜变性 (IRD) 包括由形成光感受器外段的特殊原发性纤毛的结构紊乱或功能障碍引起的视网膜纤毛病 。光感受器初级纤毛通过在过渡区上方存在含有视觉色素和其他光转导蛋白的膜盘来适应光检测 。光感受器初级纤毛的结构类似于其他初级纤毛,一项对小鼠光感受器初级纤毛的综合蛋白质组学研究确定了大约 2000 种蛋白质,其中数百种蛋白质存在于其他初级纤毛中。遗传性视网膜变性 最常见的原因是色素性视网膜炎 (RP)。色素性视网膜炎是一组异质的遗传性疾病,会导致视网膜视杆细胞和视锥细胞进行性退化,导致周边和中心视力进行性丧失,影响全世界 3000-8000 人中的 1 人。色素性视网膜炎具有常染色体显性遗传、常染色体隐性遗传和 X 连锁遗传模型,它可以以综合征和非综合征的性质发生。
初级纤毛在维持体内平衡的其他器官中具有重要作用。它们充当血管内皮上的机械感觉细胞器,它们的功能障碍导致动脉粥样硬化变化和高血压。在肾小管和集合管中,初级纤毛调节尿流、渗透压和成分。此外,肾脏原发性纤毛信号通路的缺陷会导致肾功能损害,这是原发性纤毛病最常见的症状 。后者表现出的病理范围从看似正常的肾脏中的尿液浓缩障碍到囊性发育不良的肾脏。肾脏超声可以显示由于囊肿引起的正常大小、小肾脏和大肾脏,回声变化和皮质髓质分化异常。
视网膜病与肾脏病共病的基因解码基因检测研究提出一例肾移植患者的色素性视网膜炎病例。
2.病例报告
视网膜病与肾脏病共病的基因解码基因检测研究研究了一名 63 岁的肾移植患者,该患者通过致病基因鉴定基因解码基因检测明确体内的基因突变是色素性视网膜炎发生的明确原因。患者自述有色素性视网膜炎的阳性家族史(他的兄弟也受此影响),尽管他没有接受基因检测。根据病史,20岁时因红细胞尿症在肾内科医生的建议下进行了扁桃体切除术,32岁时因恶性高血压接受治疗(眼底检查显示双眼视盘水肿)。患者在 56 岁时被诊断出患有慢性肾功能衰竭。肾脏超声显示小的高回声肾脏有囊肿和缺乏皮质髓质分化。由于肾脏疾病的进一步进展,2016年,肾脏替代治疗首先通过中心静脉导管进行血液透析,然后通过腹膜透析开始。2017年,进行了死者肾脏进行肾移植。他目前正在肾病专家的监督下,以应对移植器官在 COVID-19 后可能出现的排斥反应。同时,当发现肾脏参数值升高时,视觉功能也开始出现问题。在眼科病历中,他说他的双眼视力受损,尤其是左侧。2016年眼科检查,疑似色素性视网膜炎,建议患者做进一步检查。由于频繁的透析治疗和肾移植准备,他推迟了进一步的眼科评估。但是,经过一段时间后,进行了进一步的测试,例如标准眼科检查、黄斑和视盘的光谱域光学相干断层扫描 (SD-OCT) 、具有中央视觉程序的视野 (Octopus)、视网膜电图,以及 2021 年底的基因检测。基因检测证实了视网膜色素变性的诊断;该患者是 RP1c.2029C>T 杂合子,p(ARG677*) 被认为是致病性的,GPR179 c.1368del 杂合子,p(Phe456Leufs*30),这可能是致病的。
所有眼科临床观察发现和进行的诊断测试的结果总结在表1和表 2.
表1:眼科临床发现
|
|
右眼
|
左眼
|
|
最佳矫正视力
|
0.4
|
带投影的光感
|
|
眼压
|
15 毫米汞柱
|
15 毫米汞柱
|
|
眼前节
|
后囊下白内障; 瞳孔反应减弱
|
黄斑角膜混浊; 后囊下白内障; 瞳孔反应减弱
|
|
眼底
|
蜡状椎间盘苍白; 视网膜血管衰减; 骨针状色素沉积; 中央凹的结构变化
|
波浪盘苍白; 视网膜血管衰减; 骨针状色素沉积; 中央凹的结构变化
|
表 2:眼科诊断检测
|
|
右眼
|
左眼
|
|
SD-OCT(黄斑)
|
光感受器和视网膜色素上皮的内/外段被破坏和变薄(图1A)
|
光感受器和视网膜色素上皮的内/外段被破坏和变薄(图1B)
|
|
SD-OCT(视盘)
|
扁平的视神经乳头与变薄的视神经(图 2A)
|
扁平的视神经乳头与变薄的视神经(图 2B)
|
|
计算机化视野测量
|
保留中央 10⁰ 视野(图 3A)
|
绝对暗点(图 3B)
|
|
视网膜电图
|
延迟隐性时间和暗视杆振幅减少,明视康和闪烁反应(图 4)
|
严重延迟隐性时间和暗视杆幅度降低、明视控制和闪烁反应(图 4)
|
3. 眼科与肾脏共病的致病基因鉴定基因解码基因检测讨论
RP1 基因编码一个蛋白质家族,这些蛋白质被认为是光感受器初级纤毛中的结构和功能成分,在视杆和视锥细胞的外部部分的组织中发挥重要作用,确保正确的方向和信号传导 。RP1 是一种可溶性蛋白质,专门集中在新形成的轴丝盘膜中,在外段和过渡区的交界处含有视觉信号转导通路的成分 。由 RP1 基因检测突变引起的疾病发展的真正机制尚不完全清楚,可能的原因很少。RP1突变可能导致椎间盘膜中肌动蛋白、钙粘蛋白和肌球蛋白之间的异常连接,导致它们的不稳定和感光细胞死亡。此外,研究表明,小鼠视紫红质可能的错误定位是由于突变的 RP1 蛋白参与了视紫红质在整个过渡区的运输。RP1 疾病的这两种可能原因仅与感光器功能有关。
位于 8 号染色体上的 RP1 基因首次在肯塔基州东南部的一个常染色体显性遗传性色素性视网膜炎家族中被发现 。RP1 基因杂合突变的个体可以保持视力直到生命的最后几十年,而隐性遗传的 RP1 基因检测突变可能导致生命早期的严重疾病形式 。提到的基因变体 (RP1 c.2029C> T, p. (ARG677*) 是导致 ad色素性视网膜炎的无义突变,但有研究证实从头突变 。由截短的 RP1 蛋白引起的 色素性视网膜炎最合乎逻辑的解释是一种显性负机制,其中截短的 RP1 蛋白竞争结合轴丝微管并干扰初级纤毛的稳定性。ad色素性视网膜炎突变在 RP1 基因的最后一个外显子 (4) 中的位置支持截短蛋白的理论,并驳斥了功能获得或新毒性效应的可能解释 。RP1 疾病表型严重程度的变化,其中已证实杂合 Arg677ter 基因检测突变的个体中的非外显率或最小疾病表达表明可能受到未知遗传和/或环境因素的影响。在疾病的非综合征形式中,从头 Arg677ter 基因检测突变支持 RP1 基因中突变热点的假设 ,而另一方面,研究表明从头突变被认为在综合征视网膜中起重要作用。涉及智力障碍的纤毛病。
RP1 基因与双皮质素 (DCX) 的神经元微管相关蛋白结合结构域具有有限的同源性,因此,RP1 蛋白是第一个被鉴定的光感受器微管相关蛋白 (MAP) 。到目前为止,RP1 基因检测突变与孤立形式的视网膜变性相关,但没有系统性疾病,但另一方面,RP1 蛋白在肾单位远端小管和集合管中表达。RP1 蛋白作为 MAP 包含 DCX 结构域,可通过促进微管的伸长或缩短来控制体内轴突长度和稳定性。RP1 是 MAP 的发现为肾脏疾病的病理生理学提供了可能的基础,这表明 RP1 蛋白可能在调节肾脏初级纤毛的轴丝长度和稳定性方面发挥作用。
在过去的十年中,已经有大量的 遗传性视网膜变性 临床研究,并在 2017 年底,批准了第一个用于 RPE65 双等位基因变异患者的基因疗法 Luxturna。因此,当怀疑色素性视网膜炎时,关键是进行基因检测以确定潜在的突变。该疗法基于腺相关载体的视网膜下注射,提供健康的 RPE65 基因拷贝,并使活的视网膜细胞能够产生缺失的酶。治疗效果通过视力、视野、光敏感度和多亮度移动性测试来评估,在该测试中,患者在不同光照水平下绕过障碍物来测量日常生活活动中的功能性视力 。许多新的治疗方法仍在测试中,例如晚期 色素性视网膜炎的光遗传学治疗。这种疗法结合了视网膜下注射编码光遗传学传感器的基因,这是一种光门控阳离子通道,可以通过高科技护目镜受到光的刺激。使用光激活视网膜细胞的光遗传学疗法可能有助于所有类型的 色素性视网膜炎。此外,遗传性视网膜变性 最有希望的治疗方法是干细胞的玻璃体内移植。RP1 基因的突变导致 3-5% 的常染色体显性视网膜色素变性病例。直到今天,视网膜病与肾脏病共病的基因解码基因检测研究还没有足够的疗法来治疗由 RP1 基因检测突变引起的疾病。杂合子家族成员不患有 色素性视网膜炎症状的病例表明,RP1 基因的一个健康等位基因可以预防视杆细胞和视锥细胞的视网膜变性。因此,治疗由截短的 RP1 蛋白引起的视网膜变性的未来可能是一种基因疗法,它可以使突变的等位基因的表达保持沉默 。
4. 肾病与眼病共协会关于基因检测应用的共识
视网膜病与肾脏病共病的基因解码基因检测研究的报告说明了一个罕见的 RP1 基因突变 (RP1c.2029C> T, p. (ARG677*),迄今为止,该突变仅与患有系统性疾病的患者的孤立形式的视网膜变性有关,高血压和慢性肾功能衰竭。了解这些病理状况可以帮助眼科医生或其他医生识别看似无关的疾病之间的联系,并怀疑是否存在全身性疾病。此外,了解肾脏和眼睛疾病的病理生理学可能会导致以下疾病的发展肾脏和眼部疾病的新临床检查方案和治疗策略。
 右眼黄斑的 SD-OCT 图像;( B ) 左眼黄斑的 SD-OCT 图像.jpg)
图1:( A ) 右眼黄斑的 SD-OCT 图像;( B ) 左眼黄斑的 SD-OCT 图像。
 右眼视盘的 SD-OCT 图像;( B ) 左眼视盘的 SD-OCT 图像.jpg)
图 2:( A ) 右眼视盘的 SD-OCT 图像;( B ) 左眼视盘的 SD-OCT 图像。
 右眼视野;( B ) 左眼视野.jpg)
图 3:( A ) 右眼视野;( B ) 左眼视野。
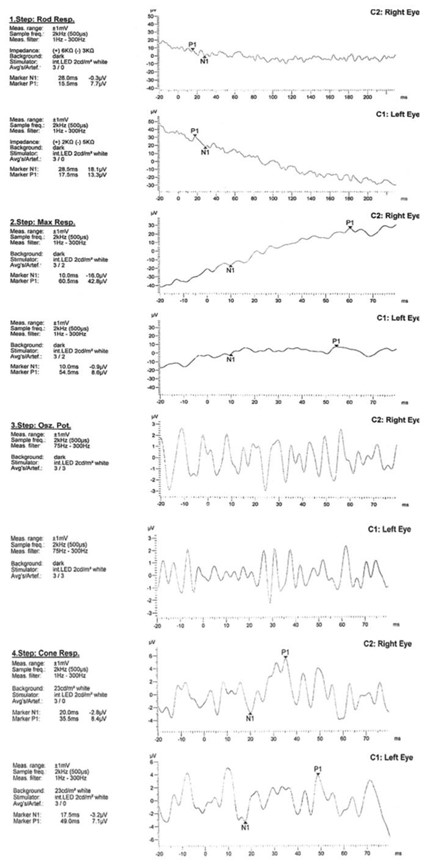
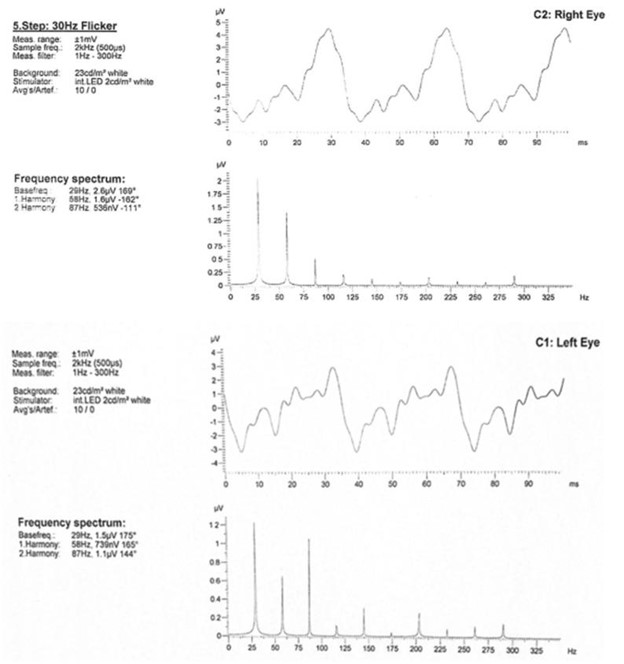
图 4:视网膜电图检查。
与本文内容相关的更多研究结果请参阅:Int J Mol Sci. 2022 Jul; 23(14): 7582.
Published online 2022 Jul 8. doi: 10.3390/ijms23147582
Retinal Ciliopathy in the Patient with Transplanted Kidney: Case Report
(责任编辑:admin)



